Вуглеводний обмін включає розщеплення вуглеводів в травному каналі до моносахарів, синтез і розпад глікогену в тканинах, анаеробне і аеробне розщеплення глюкози та глюконеогенез.
Вуглеводний обмін у дітей характеризується значно більшою інтенсивністю, ніж у дорослих. Для них також властива висока лабільність обміну вуглеводів, виражена тим більше, чим менша дитина. Діти, особливо раннього віку, не переносять безвуглеводної їжі. Так, у дітей раннього віку після двох днів безвуглеводного харчування цукор крові натще може знизитись на 1,3-1,6 ммоль/л, тоді як у дорослих за тих же умов лише на 0,6-1,2 ммоль/л.
Вуглеводи виконують в організмі людини важливі і різноманітні функції. Вони є основним джерелом енергії, у вигляді мукополісахаридів входять до складу сполучної тканини, а у вигляді складних сполук (глікопротеїди, ліпополісахариди) є структурними елементами клітин, а також складовими частинами деяких біологічно активних речовин (ферменти, гормони, імунні тіла тощо). Частка вуглеводів у раціоні харчування дітей значною мірою залежить від віку. У дітей першого року життя вміст вуглеводів, які забезпечують потребу в калоріях, становить 40%. Після року він збільшується до 60%. У перші місяці життя потреба у вуглеводах покривається за рахунок молочного цукру (лактози), що входить до складу жіночого молока. При штучному вигодовуванні молочними сумішами дитина також отримує сахарозу або мальтозу. Після введення прикорму дитина починає одержувати полісахариди (крохмаль, частково глікоген), які в основному покривають потреби організму у вуглеводах.
Такий характер харчування дітей сприяє як утворенню амілази підшлункової залози, так і її виділенню із слиною. В перші дні і тижні життя амілаза практично відсутня, а слиновиділення незначне, і лише з 3-4 міс. починається секреція амілази і різко зростає слиновиділення.
Відомо, що гідроліз крохмалю відбувається при дії амілаз слини і панкреатичного соку: крохмаль розщеплюється до мальтози і ізомальтози.
Поряд з дисахаридами їжі — лактозою і сахарозою — мальтоза та ізомальтоза на поверхні кишкових ворсинок під впливом дисахаридаз розщеплюються до моносахаридів: глюкози, фруктози і галактози, які підлягають резорбції через клітинну оболонку. Процес резорбції глюкози і галактози зв’язаний з активним транспортом, який полягає у фосфорилюванні моносахаридів і перетворенні їх в глюкозофосфати, а потім в глюкозо-6-фосфат (відповідно галактозофосфати). Така активація відбувається під впливом глюкозо-або галактозокіназ із затратою одного макроергічного зв’язку АТФ. На протилежність глюкозі і галактозі фруктоза резорбується майже пасивно шляхом простої дифузії.
Дисахаридази в кишках плода формуються залежно від терміну гестації, причому раніше підвищується активність мальтази і сахарази (6-8 міс. гестації), пізніше (8-10 міс.) — лактази. Вивчена активність різних дисахаридаз в клітинах слизової оболонки кишки і встановлено, що загальна активність на час народження в результаті дії всіх мальтаз при розщепленні мальтози становить в середньому 246 мкмоль, загальна активність сахарази — 75 мкмоль, ізомальтази — 45 мкмоль, лактази — 30 мкмоль розщепленого дисахарида на 1 г білка за 1 хв. Ці дані викликають великий інтерес у педіатрів, оскільки стає ясно, чому грудна дитина добре перетравлює декстринмальтозні суміші, в той час як лактоза легко викликає діарею.
Відносно низькою активністю лактази в слизовій оболонці тонкої кишки пояснюється той факт, що лактазна недостатність спостерігається частіше, ніж недостатність інших дисахаридаз. Зустрічається як транзиторна мальабсорбція лактози, так і вроджена. Перша її форма обумовлена затримкою дозрівання кишкової лактази, яка з віком дитини зникає. Вроджена ж форма може спостерігатися більш тривалий час, але, як правило, найбільш виражена з народження при грудному вигодовуванні. Це пояснюється тим, що вміст Молочного цукру (лактози) в жіночому молоці майже в 2 рази більший, ніж в коров’ячому. Клінічно у дитини виникає діарея, для якої характерні поряд з частим випорожненням (більше 5 разів на добу) пінисті випорожнення кислої Реакції (pH менше 6). Можуть спостерігатися і симптоми дегідратації, що Проявляються тяжким станом.
Таким чином, вуглеводний обмін у дітей раннього віку характеризується високим засвоєнням вуглеводів (98-99%) незалежно від характеру вигодовування.
У більш старшому віці відбувається так звана репресія лактази, коли її активність значно знижується. Цим пояснюється те, що більшість людей не переносять молока, в той час як кисломолочні продукти (кефір, ацидофілія, простокваша) засвоюються добре. На лактазну недостатність хворіють близько 75% негрів та індійців, до 90% осіб азіатського походження і 20% кавказців.
Рідше спостерігається вроджена мальабсорбція сахарози і мальтози, яка частіше проявляється у дітей в разі штучного вигодовування, оскільки більшість молочних сумішей збагачується сахарозою, або при включенні до раціону соків, фруктів, овочів, що містять цей дисахарид. Клінічні прояви сахарозної недостатності аналогічні таким при лактозній мальабсорбції.
Описані аналогічні клінічні прояви і при порушенні активування моносахаридів — глюкози і галактози. їх слід відрізняти від випадків, коли в раціоні харчування міститься надто велика кількість цих моносахаридів, які при надходженні до кишок мають високу осмотичну активність, що й викликає надходження до кишок води. Оскільки всмоктування моносахаридів відбувається з тонкої кишки в систему v.portae, вони в першу чергу надходять до гепатоцитів. Залежно від умов, які визначаються головним чином рівнем глюкози в крові, моносахариди перетворюються в глікоген або залишаються у вигляді моносахаридів і розносяться з кровообігом. У крові дорослих вміст глікогену дещо менший (0,075 — 0,117 г/л), ніж у дітей (0,117 — 0,206 г/л).
Синтез резервного вуглеводу організму — глікогену — відбувається групою різних ферментів, в результаті чого утворюються розгалужені молекули глікогену, що складаються з глюкозних залишків, які сполучуються 1,4 або 1,6 зв’язками (бокові ланцюги глікогену утворюються 1,6 зв’язками). У разі необхідності глікоген знову зможе розщеплюватися до глюкози.
Процес глікогеноутворення у плода і дорослої людини ідентичний, однак існують вікові відмінності в ступені його активності. Так, встановлено, що у плода в останні 2-3 міс. внутрішньоутробного розвитку відбувається дуже активний синтез глікогену. Але вже в перші години після народження майже весь глікоген розщеплюється для забезпечення енерговитрат організму, а його синтез не відбувається фактично до кінця 2-го початку 3-го місяця життя дитини.
Вміст глікогену в печінці в останні тижні вагітності досягає 10% маси органа, але протягом першої доби життя він знижується до 1%.
Таким чином, доношені новонароджені мають досить великі резерви глікогену, які можуть забезпечити майже 20-годинну потребу організму, тоді як недоношені діти мають недостатню кількість глікогену. Причому для дітей раннього віку характерною є недостатня глікогенсинтезуюча зтатність печінки, а також швидке виснаження запасів вуглеводів із печінки.
Крім того, можуть спостерігатися вроджені дефекти ензимних систем, при яких синтез або розпад глікогену в печінці або м’язах може порушуватися. Д° цих станів належить хвороба недостачі резервів глікогену. В її основі лежить дефіцит ферменту глікогенсинтетази. Рідкість цього захворювання, певно, пояснюється труднощами діагностики і швидким несприятливим наслідком. У новонароджених дуже рано спостерігається гіпоглікемія (навіть в перерві між годуваннями) з судомами і кетозом. Частіше ж в літературі описують випадки глікогенової хвороби, при якій в організмі накопичується глікоген нормальної структури або утворюється глікоген неправильної структури, що нагадує целюлозу (амілопектин). Ця група, як правило, генетично детермінована. Залежно від дефіциту тих чи інших ферментів, які беруть участь у метаболізмі глікогену, виділяють різні форми, або типи, глікогенозів (рис. 48).
В основі І типу, до якого належить гепаторенальний глікогеноз, або хвороба Гірке, лежить недостатність глюкозо-6-фосфатази. Це найтяжчий варіант серед глікогенозів без структурних порушень глікогену. Захворювання передається за рецесивним типом спадковості. Клінічно проявляється відразу після народження або в грудному віці. Характерна гепатомегалія, яка супроводжується гіпоглікемічними судомами і комою, кетозом; селезінка не збільшена. В подальшому спостерігаються відставання в рості, диспропорція будови тіла (живіт збільшений, тулуб подовжений, ноги короткі, голова велика). В перервах між годуванням відмічаються блідість, пітливість, втрата свідомості як результат гіпоглікемії.
II тип глікогенозу — хвороба Помпе, в основі якої лежить недостатність кислої лізосомальної а-1,4-глюкозидази. Структура глікогену нормальна, але неможливе його розщеплення. Клінічно проявляється відразу після народження, і такі діти швидко вмирають. Спостерігаються гепато- і кардіомегамія, м’язова гіпотонія (дитина не може тримати голови, ссати). Розвивається серцева недостатність.
III тип глікогенозу — хвороба Корі — обумовлений вродженим дефектом аміло-1,6-глюкозидази, ферменту, що усуває розгалуження молекули глікогену, і (або) оліго-1,4—1,4-глюканотрансферази. В результаті відкладається патологічний, так званий лімітдекстрин. Передається за аутосомним типом спадковості. Клінічні прояви схожі з такими при І типі (хвороба Гірке), але менш тяжкі. На відміну від хвороби Гірке, це обмежений глікогеноз, який не супроводжується кетозом і тяжкою гіпоглікемією. Глікоген відкладається або в печінці (гепатомегалія), або в печінці і одночасно в м’язах.
IV тип — хвороба Андерсена — обумовлений дефіцитом аміло-1,4 — 1,6- транеглюкозидази, внаслідок чого утворюється глікоген неправильної структури, який нагадує целюлозу (амінопектин). Він є неначе чужорідним тілом. Спостерігаються жовтяниця, гепатомегалія. Формується цироз печінки з портальною гіпертензією. Внаслідок цього розвивається варикозне Розширення вен шлунка і стравоходу, розрив яких викликає профузну шлункову кровотечу.
V тип — м’язовий глікогеноз, хвороба Мак-Ардла — розвивається у зв’язку з дефіцитом м’язової фосфорилази. Захворювання може проявлятися на 3-му місяці життя, коли відмічається неспроможність дітей довго ссати грудь, швидка стомлюваність. У зв’язку з поступовим накопиченням глікогену в мускулатурі спостерігається їх псевдогіпертрофія.
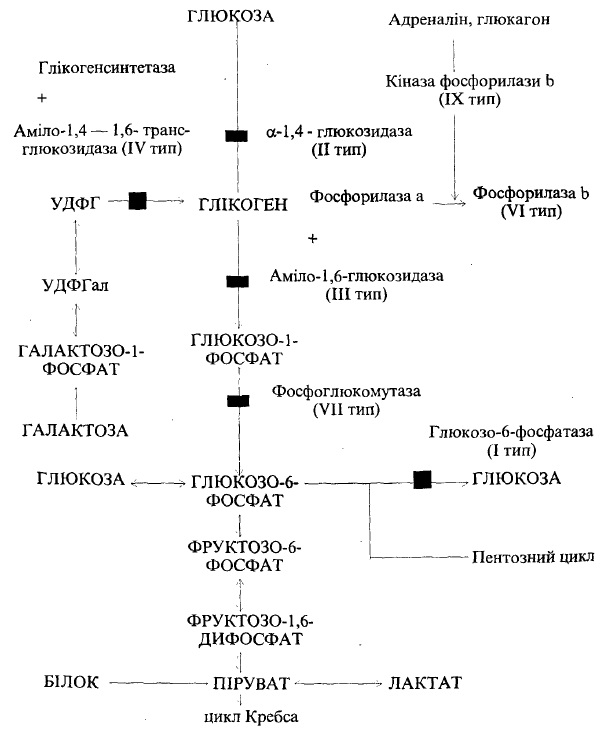
Рис. 48. Схема обміну глікогену в печінці і порушення активності ферментів при різних типах глікогенозів. Умовні позначення: УДФГ — уридиндифосфатглюкоза, УДФГал дифосфатгалактоза
VI тип глікогенозу — хвороба Герса — обумовлений дефіцитом печінкової фосфорилази. Структура глікогену нормальна. Відкладання його відбувається в печінці, лейкоцитах та еритроцитах. Клінічно виявляється гепатомегалія, рідше виникає гіпоглікемія і ацидоз. Відмічається відставання в рості. Перебіг більш сприятливий, ніж інших типів. Це найчастіший тип глікогенозу.
Тип VII — недостатня активність фосфофруктокінази. Глікоген нормальної структури, відкладається в м’язах та еритроцитах. Клінічна картина така як при V типі.
Тип VIII виникає в зв’язку з наявністю інгібітора фосфогексоізомерази. Глікоген нормальної структури, відкладається в печінці. Клінічно відмічається відчуття м’язової втоми.
Тип IX — недостатня активність фосфорилазокінази. Глікоген нормальної структури, накопичується в печінці. Клінічні симптоми такі, як при VI типі.
Спостерігаються й інші форми порушення метаболізму, при яких виявляється поліензимний дефект.
Співвідношення інтенсивності процесів глікогенезу і глікогенолізу значною мірою визначає рівень глюкози в крові — глікемію. Ця величина досить постійна. Глікемія регулюється складною системою. Центральною ланкою цієї регуляції є так званий цукровий центр, який потрібно розглядати як функціональне об’єднання нервових центрів, що знаходяться в різних відділах ЦНС, — корі головного мозку, підкірці (сочкувате ядро, смугасте тіло), гіпоталамічній ділянці, подовжньому мозку. Поряд з цим в регуляції вуглеводного обміну беруть участь багато ендокринних залоз (підшлункова, надниркова, щитовидна).
Одним з показників вуглеводного обміну є вміст глюкози в крові. На момент народження рівень глікемії у дитини становить 70-80% рівня глюкози в крові її матері, що пояснюється вільною трансплацентарною дифузією. У новонародженого на момент народження рівень глюкози становить 3,33-5,55 ммоль/л (табл. 48).
Таблиця 48. Рівень цукру (глюкози) в крові дітей та їх матерів (за методом Хагедорна-Йенсена)
| Об´єкт
дослідження |
Середня величина, ммоль/л | Межі коливань | |
| мг% | ммоль/л | ||
| Кров матері | 5,16+0,64 | 73-110 | 4,05-6,10 |
| Кров з пуповини | 4,75+0,99 | 60 -100 | 3,33-5,55 |
| Кров новонародженого | |||
| через 1 год. | |||
| після народження | 3,10+0,83 | 26-73 | 1,44-4,05 |
| через 24 год. | 3,61+0,77 | 44-94 | 2,44 – 5,22 |
| через 48 год. | 3,82+0,70 | 42-84 | 2,33 – 4,66 |
| через 72 год. | 4,20+0,89 | 40 – 100 | 2,22 – 5,55 |
| Кров дітей 1-12 міс. | – | 70-90 | 3,89 – 5,0 |
| Кров дітей 2-11 років | – | 80 – 100 | 4,4-5,55 |
| Кров дітей 12-14 років | – | 90 -120 | 5,0 – 6,66 |
Проте з перших годин життя (як правило, протягом 3-6 год.) спостерігається значне зниження вмісту глюкози. Її рівень знижується до 0,55-1,11 ммоль/л. Причому у деяких дітей рівень глюкози знижується до таких значень, які у Дорослих призводять до виникнення гіпоглікемічної коми. Це пов’язано з двома причинами. Однією з них є досить швидке виснаження запасів глікогену в організмі дитини під час пологів і новонароджений, якого не годують груддю кілька годин після народження, витрачає ці запаси. Швидке виснаження запасів глікогену обумовлене тим, що організм дитини спочатку утилізує вуглеводи, а пізніше жири до тих пір, поки не зможе покрити енергетичні витрати киванням їжі. Другою причиною гіпоглікемії у новонароджених є недостатня кількість контрінсулярних гормонів. Це підтверджується тим, що адреналін і глюкагон здатні підвищувати рівень глюкози в крові на даний період.
До 5-6-го дня життя вміст глюкози збільшується, але її рівень у дітей залишається відносно нижчим, ніж у дорослих. Підвищення вмісту глюкози в крові дітей після першого року життя хвильоподібне (перша хвиля — до 6 років, друга — до 12 років), що збігається з підсиленим ростом дитини і більш високою концентрацією соматотропного гормону.
Слід пам’ятати, що у дітей до 7-річного віку зберігається схильність до гіпоглікемічних реакцій при недостатньому забезпеченні харчування вуглеводами, і тільки після 7 років життя стабілізується регуляція рівня глюкози в крові.
Необхідно підкреслити, що наведені дані рівня цукру в крові отримані за методом Хагедорна-Ієнсена, який є менш точним, порівняно з іншими методами, зокрема глюкозооксидазним або ортотолуїдиновим методом. Якщо рівень глюкози визначається глюкозооксидазним або ортотолуїдиновим методом, то її вміст на 10% нижчий, ніж визначений за методом Хагедорна- Ієнсена. Так, у дітей грудного віку рівень глюкози вранці натще за глюкозооксидазним методом становить 2,78-4,4 ммоль/л, у дітей раннього віку — 3,3-5 ммоль/л і у школярів — 3,3-5,5 ммоль/л.
Рівень глюкози в крові вранці натще у дітей, який перевищує 6,1 ммоль/л (за глюкозооксидазним методом) або 6,66 ммоль/л (за методом Хагедорна-Ієнсена) вважають гіперглікемією, а зниження рівня відповідно до 2,5 та 2,8 ммоль/л — гіпоглікемією.
Слід звернути увагу ще на одну особливість вуглеводного обміну, яка може бути причиною низького рівня глюкози. В дитячому організмі послаблені процеси глюконеогенезу, тобто утворення вуглеводів із невуглеводних сполук, наприклад із жирів, білків та деяких інших продуктів. Вважають, що це обумовлено посиленим розпадом білкових і жирових запасів, які необхідні для швидкого росту дитячого організму.
Важливим показаником вуглеводного обміну є толерантність організму до глюкози, тобто здатність її утилізувати при навантаженні, наприклад після орального чи внутрішньовенного введення глюкози.
У новонароджених нижча, ніж у дорослих, толерантність до глюкози. Про це свідчить більш тривалий (в 2 рази) півперіод елімінації глюкози із крові. Однак вже на 10-й день життя рівень утилізації глюкози тканинами стає приблизно таким, як і у дорослих. У грудному віці толернатність до глюкози різко збільшується, перевищуючи більш ніж в 2 рази відповідні показники у дорослих. Навіть у віці 7-14 років зберігається дещо вища толерантність до глюкози, ніж у дорослих.
Оскільки толерантність дітей до навантаження вуглеводами вища, то це потрібно враховувати при дослідженні глікемічних кривих. Так, для дослідження глікемічної кривої у дорослих застосовується навантаження в середньому 1 г/кг. У дітей же чим менший їх вік, тим більшим повинно бути навантаження, щоб отримувати аналогічний тип глікемічних кривих. Наприклад, у віці до 1,5 року навантаження визначається з розрахунку 2,5 г/ кг, 1,5-3 роки — 2 г/кг, 3-12 років— 1,75 г/кг, старших 12 років— 1,25 г/кг. Але навіть при таких навантаженнях глюкозою її рівень в крові дітей нижчий, ніж у дорослих.
Після орального навантаження глюкозою (мал.20) через 30 хв. у здорових дітей спостерігається максимальне підвищення рівня глюкози (за глюкозо- оксидазним методом) до 9,99 ммоль/л (180 мг%), а в подальшому відбувається поступове зниження рівня глюкози: через 60 хв. — не вище 8,88 ммоль/л (160 мг%), через 120 хв. — 7,77 ммоль/л (140 мг%).
Якщо у дитини вранці натще рівень глюкози в крові (за глюкозооксидазним методом) перевищує 5,5 ммоль/л і рівень глікемії після навантажання глюкозою перевищує вказані вище показники, то встановлюють діагноз цукрового діабету.
У дітей відмічається більш тяжкий перебіг цукрового діабету, в лікуванні якого, як правило, необхідно застосовувати інсулін. Цукровий діабет у дітей найчастіше виявляється в періоди особливо інтенсивного росту (перше і друге фізіологічне витягування), коли частіше спостерігається порушення кореляції ендокринних залоз (підвищується активність соматотропного гормону Ппофіза). Клінічно діабет у дітей проявляється спрагою (полідипсія), поліурією, Полакійурією, схудненням, часто підвищенням апетиту (поліфагія). Виявляється Підвищення вмісту глюкози в крові (гіперглікемія) і поява її в сечі (глюкозурія). Часто спостерігаються прояви кетоацидозу.
В основі захворювання лежить недостатність інсуліну, яка утруднює проникнення глюкози через клітинні оболонки. Це викликає підвищення вмісту глюкози в екстрацелюлярній рідині і крові, а також підсилює розпад глікогену.
В організмі розпад глюкози може відбуватися кількома способами. Найважливішими з них є гліколітичний ланцюг і пентозний цикл. Розщеплення за гліколітичним ланцюгом може перебігати як в аеробних, так і в анаеробних умовах. В аеробних умовах воно призводить до утворення пірувату (піровиноградна кислота), а в анаеробних – лактату (молочна кислота).
У печінці і міокарді процеси перебігають аеробно, в скелетних м’язах при підсиленій роботі — переважно анаеробно, під час спокою — переважно аеробно. Для організму більш економічним є аеробний шлях, оскільки при цьому утворюється більше АТФ, яка несе великий запас енергії. Анаеробний гліколіз менш економічний. В цілому шляхом гліколізу клітини можуть швидко, хоч і неекономічно, постачатися енергією незалежно від доставки кисню. Аеробне розщеплення в комбінації гліколітичний ланцюг-цикл Кребса є / основним джерелом енергії для організму.
У той же час шляхом зворотного перебігу гліколітичного ланцюга організм може здійснити синтез вуглеводів з проміжних продуктів обміну, наприклад з піровиноградної і молочної кислот. Перетворення амінокислот в піруват, а- кетоглутарат і оксалацетат може призвести до утворення вуглеводів. Процеси гліколітичного ланцюга локалізовані в цитоплазмі клітин.
Інтенсивність і співвідношення аеробного і анаеробного процесів розщеплення вуглеводів мають чітку вікову залежність. В тканинах ембріона переважає активність ферментів анаеробного розпаду над ферментами аеробного окислення. Це пов’язано з тим, що умови внутрішньоутробного розвитку характеризуються відносно низьким рівнем кисню. Цей же шлях перетворення вуглеводів залишається досить активним в багатьох тканинах новонародженого і дитини першого місяця життя. Інтенсивність процесів гліколізу у новонароджених на 30-35% вища, ніж у дорослих, і знижується в перші місяці постнатального періоду.
Дослідження співвідношення метаболітів гліколітичного ланцюга і циклу Кребса в крові дітей показує досить значну різницю порівняно з дорослими (табл. 49).
Таблиця 49. Нормальні величини деяких метаболітів (ммоль/л) гліколітичного ланцюга і циклу Кребса в сироватці крові
| Кислота | Новонарод
жений |
Дитина грудного віку | Дитина, старша року | Дорослий |
| Молочна
Піровиноградна |
2-2,4 1,3-1,8
1-1,7 0,5-1,5 0,17-0,32 0,06-0,11 0,05-0.09 До 0,1 |
|||
Як видно з табл. 49, в сироватці крові новонародженого і дитини першого року життя міститься досить значна кількість молочної кислоти, що свідчить про перевагу анаеробного гліколізу. Організм дитини прагне компенсувати надмірне накопичення молочної кислоти (лактат) підвищенням активності ферменту — лактатдегідрогенази, який перетворює молочну кислоту в піровиноградну з наступним її включенням до циклу Кребса.
Існують і деякі відмінності вмісту ізоферментів лактатдегідрогенази. У дітей раннього віку вища активність 4-ї та 5-ї фракцій і нижчий вміст 1-ї фракції, що забезпечує високу активність ферменту в анаеробних умовах.
Другим, не менш важливим шляхом розщеплення глюкози є пентозний цикл, який починається з гліколітичного ланцюга на рівні глюкозо-6-фосфату. В результаті одного циклу з 6 молекул глюкози одна повністю розщеплюється до С02 і Н20. Це коротший і швидший шлях розпаду, який забезпечує виділення більшої кількості енергії. Внаслідок пентозного циклу також утворюются пентози, які використовуються організмом для синтезу нуклеїнових кислот. Очевидно, цим і пояснюється те, що у дітей пентозний цикл має суттєве значення. Ключовим його ферментом є глюкозо-6-фосфатдегідрогеназа, яка забезпечує зв’язок між гліколізом і пентозним циклом. Активність цього ферменту в крові дітей з віком поступово знижується.
Порушення пентозного циклу розщеплення глюкози внаслідок дефіциту глюкозо-6-фосфатдегідрогенази лежить в основі гемолітичної несфероцитарної спадкової анемії (один з видів еритроцитопатій), яка проявляється анемією, жовтяницею, спленомегалією. Як правило, гемолітичні кризи провокуються прийомом лікарських засобів (хінін, хінідін, сульфаніламіди, деякі антибіотики та ін.), які підсилюють блокаду цього ферменту.
Аналогічна клінічна картина гемолітичної анемії спостерігається внаслідок недостатньої кількості піруваткінази, яка каталізує перетворення фосфо-енолпірувата в піруват, їх розрізняють з допомогою лабораторного методу, визначаючи активність цих ферментів у еритроцитах.
Порушення гліколізу в тромбоцитах лежить в основі патогенезу багатьох тромбастеній, які клінічно проявляються підвищеною кровоточивістю при нормальній кількості кров’яних платівок, але зі зміненою їх функцією (агрегація) і збереженими факторами зсідання крові.
Відомо, що метаболізм організму людини ґрунтується на перетворенні глюкози. Інші гексози (галактоза і фруктоза), як правило, трансформуються у глюкозу і підлягають повному розщепленню. Перетворення цих гексоз в глюкозу здійснюють ферментні системи. Дефіцит ферментів, трансформуючих Це перетворення, лежить в основі галакто- та фруктоземії. Це генетично обумовлені ферментопатії.
При галактоземії існує дефіцит галактозо-1-фосфатуриділтрансферази. Внаслідок цього в організмі відбувається накопичення галактозо-1-фосфату. Крім цього, вилучається із кровообігу велика кількість фосфатів, що обумовлює недостатню кількість АТФ, викликаючи зниження енергетичних процесів у клітинах.
Перші симптоми галактоземії з’являються незабаром після початку годування дітей молоком, особливо жіночим, що містить велику кількість лактози, до складу якої входить однакова кількість глюкози і галактози. З’являється блювота, недостатньо підвищується маса тіла (розвивається гіпотрофія). Потім розвивається гепатоспленомегалія з жовтяницею і катаракта. Можливий розвиток асциту і варикозного розширення вен стравоходу і шлунка. При дослідженні сечі виявляється галактозурія.
При галактоземії необхідно виключити з харчування лактозу. Використовуються спеціально приготовлені молочні суміші, в яких різко зменшений вміст лактози. Це забезпечує правильний розвиток дітей.
У разі порушення перетворення фруктози в глюкозу внаслідок дефіциту фруктозо-1-фосфатальдолази розвивається фруктоземія. Її клінічні прояви аналогічні при галактоземії, але менш виражені. Найхарактернішими її симптомами є блювота, різке зниження апетиту (до анорексії), котрі виникають при введенні в раціон фруктових соків, підсолоджених каш та пюре (в сахарозі містяться фруктоза і глюкоза). Тому клінічні прояви особливо посилюються при переведенні дітей на змішане і штучне вигодовування. В більш пізньому віці хворі не переносять солодощі і особливо мед, який містить очищену фруктозу. При дослідженні сечі виявляють фруктозурію.
Необхідно виключити з раціону харчування сахарозу і продукти, в яких міститься фруктоза.