Розвиток серцево-судинної системи людини у внутрішньоутробному періоді життя можна розподілити на два основних періоди. Перший період — це період оформлення серцево-судинної системи, другий — період Ті подальшого розвитку та дозрівання.
Період оформлення починається з 2-го тижня і закінчується наприкінці 3- го місяця внутрішньоутробного життя. Цей період можна розподілити на три окремі, хоча й нерідко відмежовані фази.
Перша фаза включає утворення судин та первинної серцевої трубки.
Закладка судин спостерігається наприкінці 2-го тижня ембріонального розвитку, коли в мезодермі зародкового листка з’являються скупчення клітин, що утворюють кров’яні острівки. Надалі з цих острівків формуються первинні судини.
Розвиток серця починається у ембріона з 3-го тижня внутрішньоутробного періоду з частини мезодерми. В ділянці майбутньої шиї з’являються два самостійних зачатки — первинні ендокардіальні трубки. Вони зближаються і зростаються, перегородка між ними розсмоктується. В результаті утворюється трубчасте серце, через яке кров проходить суцільним потоком (рис. ЗО). Внутрішній шар називається ендокардам, зовнішній — епіміокардом. Із зовнішнього шару надалі розвивається м’язовий шар — міокард та зовнішня оболонка, що вкриває серцр ззовні, — епікард.
Друга фаза розвитку серця — це утворення сегментів серця та розподіл кожного сегмента.
У цій фазі спочатку каудальний кінець трубки розширений, він утворює венозний синус. Звужений ростральний кінець (конус) надалі дає початок артеріадьному стовбуру. Середня частина трубки розширюється, це — Майбутній шлуночок.
На 3-му тижні розвитку ембріона відбувається бурхливий ріст трубки. Швидке подовження серцевої трубки приводить до утворення згинів та скручування. Серцева трубка набуває S-подібної форми (рис. 30). Відбувається поворот серця навколо осі, близької до фронтальної (рис. 32).
При цьому каудальніше шлуночка утворюється передсердя. Між
шлуночком і передсердям трубка звужується, що дає початок майбутньому
пріовентрикулярному отвору. До середини 4-го тижня серце стає двокамерним (Рис. 31).
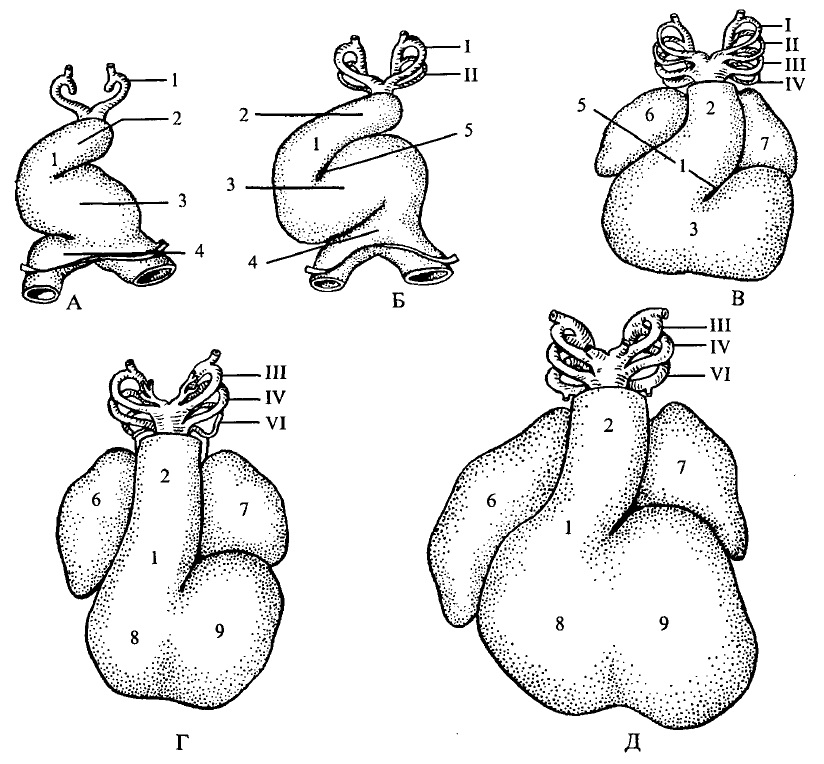
Рис. 30. Утворення серцевої петлі та розділення серця на відділи у зародка людини (вигляд з вентрального боку)
Зародки довжиною: А — 2,08 мм; Б — 3,0 мм; В — 5,2 мм; Г — 6,0 мм; Д — 8,8 мм.
1 — конус; 2 — артеріальний стовбур; 3 — шлуночок; 4 — передсердя; 5 — конусошлуночкова борозна; 6 — праве передсердя; 7 — ліве передсердя; 8 — правий шлуночок; 9 — лівий шлуночок. Римськими цифрами позначено відповідні дуги аорти.
З кінця 4-го тижня починається розподіл передсердь. Формується міжпередсердна перетинка. Її утворення завершується до кінця 5-го тижня. Серце стає трикамерним. Передсердна перетинка має отвір — овальний отвір і передсердя з’єднуються між собою (мал. 31). З лівого боку овального отвору наявний клапан, тому скид крові відбувається в одному напрямку — справа наліво.
На 5-му тижні внутрішньоутробного періоду починає розвиватися міжшлуночкова перетинка. В її утворенні беруть участь ендокард і міокард. Міжшлуночкова перетинка росте від верхівки у напрямку до передсердь. Деякий час у верхній частині перетинки зберігається отвір, який пізніше заростає сполучнотканинною перетинкою. Розподіл шлуночка завершується упродовж 7-го тижня (мал. 31). Одночасно з цим загальний артеріальний стовбур розподіляється на аорту та легеневий стовбур, але вони між собою з’єднуються артеріальною (боталовою) протокою. Клапанний апарат серця виникає після утворення перетинок. Клапани формуються як дублікатура ендокардіального шару. До кінця 7-8-го тижня серце стає чотирикамерним (рис. 31).
З 4-го тижня починає формуватися провідна система серця. Відмічається формування основних елементів провідної системи: синусного вузла (Кіса-Флека), атріовентрикулярного вузла (Ашоффа-Тавари), пучка Гіса та волокон Пуркіньє. Крім того, в серці ембріона виявляються «додаткові» пучки. До моменту народження вони втрачають активність чи дегенерують. Однак у 0,2% людей частина «додаткових» шляхів зберігається. Саме ці шляхи є причиною виникнення пароксизмальної тахікардії та аритмій. Описано кілька таких додаткових шляхів: а) пучки Кента (лівий і правий, між передсердями і шлуночками), б) пучок Джеймса (що з’єднує передсердя із загальною ніжкою атріовентрикулярного пучка), в) пучок Махайма — між атріовентрикулярним вузлом та міокардом шлуночків.
Наприкінці 8-го тижня починається переміщення серця з ділянки закладки, тобто шиї, в грудну порожнину.
Таким чином, структурне оформлення серця та великих судин закінчується у перші 3 місяці вагітності. Тому шкідливі фактори, що діють на ембріон і плід (вірусні захворювання матері, хімічні та лікарські речовини тощо) у перші З місяці вагітності можуть призводити до виникнення аномалій розвитку серцево-судинної системи, зокрема до утворення природжених вад серця і судин.
Найбільша вірогідність виникнення природжених вад серця відмічається при впливі на вагітну лікарських препаратів, таких як снодійні, протисудомні препарати, алкоголь, а також препаратів-антагоністів фолієвої кислоти. Можуть виникати вади серця після перенесеної краснухи під час вагітності, Цитомегаловірусної інфекції, Коксаки-інфекції, герпесу тощо. Несприятливо впливає підвищена радіація. Серед усіх новонароджених природжені вади серця зустрічаються у 0,8-1% дітей.
Розглянемо природжені вади серця і судин, що найчастіше зустрічаються і виникають під впливом несприятливих факторів.
Аномалії розміщення виникають в результаті неправильної закладки серця. При цьому серце перебуває поза середостінням. Аномалії розміщення Називають ектопією серця.
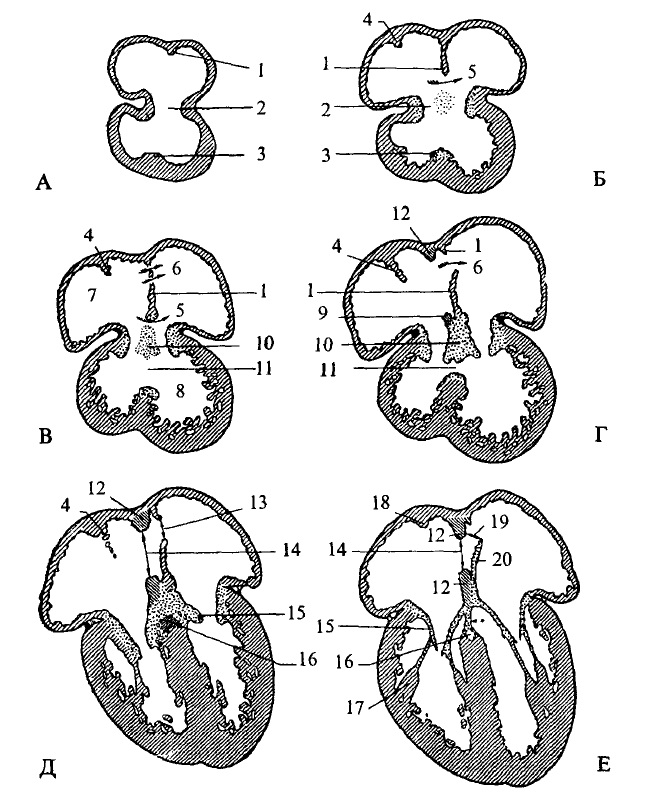
Рис. 31. Фронтальні зрізи серця зародка дитини
Довжина зародка: А – 5 мм; Б – 6-7 мм; В – 8-9 мм; Г – 12-15 мм; Д – 25-30 мм; Е -100 мм і до моменту народження.
1 – міжпередсердна первинна перетинка; 2 – атріовентрикулярний канал; З міжшлуночкова перетинка; 4 – septum spurium; 5 – первинний отвір; 6 – вторинний отвір; 7 – праве передсердя; 8 – лівий шлуночок; 9 – вторинна перетинка (каудальна частина); 10 – подушка атріовентрикулярного каналу; 11 – міжшлуночковий отвір (закривається, коли зародок досягає 15-17 мм); 12 – вторинна перетинка; 13 – вторинний отвір У первинній перетинці; 14 – овальний отвір; 15 – атріовентрикулярні клапани; 16 – передсердно-шлуночковий пучок; 17 – сосочковий м´яз; 18 – пограничний гребінь; 19 – функціональний овальний отвір; 20 – первинна перетинка, що перетворилась у клапан овального отвору.
Розрізняють такі види ектопій серця:
- Шийна ектопія, яка характеризується розміщенням серця в ділянці шиї, тобто у місці його первинної закладки. Це досить рідкісна аномалія. Звичайно зустрічається при виражених виродливостях плода.
- Торакальна ектопія, яка характеризується розміщенням серця на передній поверхні грудної клітки. Серце звичайно оголене або частково вкрите шкірою чи перикардом.
- Абдомінальна ектопія, яка характеризується розміщенням серця в черевній порожнині. У цьому випадку серце зміщується в черевну порожнину через отвори в діафрагмі.
При порушенні процесу повороту серця навколо фронтальної осі можливе не лівостороннє розташування серця, а правостороннє, яке називають декстрокардією (рис. 32). Можливе також утворення трикамерного серця, дефекту міжшлуночкової та міжпередсердної перетинок.
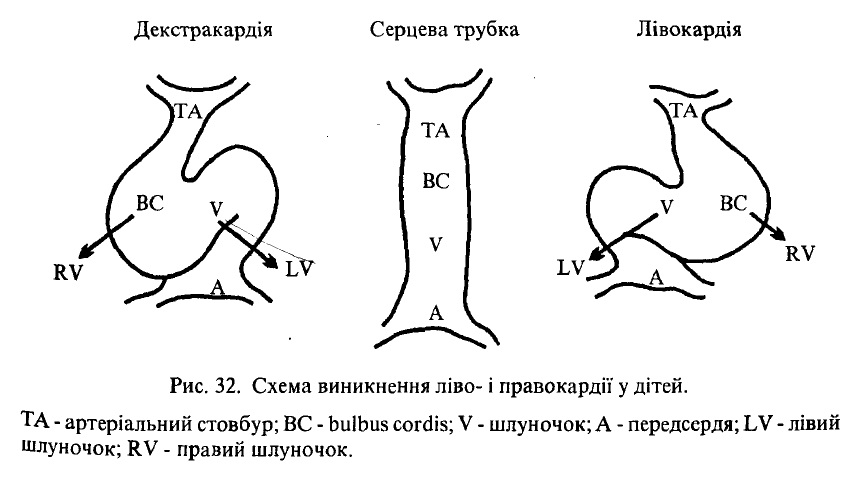
Рис. 32. Схема виникнення ліво- і правокардії у дітей.
ТА – артеріальний стовбур; ВС – bulbus cordis; V – шлуночок; А – передсердя; LV – лівий шлуночок; RV – правий шлуночок.
Ектопії серця супроводжуються іншими його вадами. Діти з ектопією серця звичайно помирають упродовж перших днів життя.
Виняток складають діти з правобічним розміщенням серця, так званою Декстрокардією. Звичайно діти з правим розміщенням серця доживають до зрілого віку.
Найбільш значні аспекти, що ілюструють фетальну циркуляцію, можна подати у вигляді кількох основоположних складових. Зокрема, кровообіг плода характеризується досить важливими особливостями, такими як:
1) плацентарний тип харчування і кровообігу плода, при якому насичення крові киснем відбувається в плаценті;
2) в тканини плода находить змішана кров (венозна і артеріальна);
3) не функціонує мале коло кровообігу.
4) правий шлуночок нагнітає приблизно 2/3 від загального серцевого викиду;
5) правий шлуночок нагнітає кров проти відносно великого навантажувального тиску;
6) легеневий кровоплин знижений, складає приблизно 7% серцевого викиду (відповідно по 3,5% на кожну легеню);
7) функціонування гемодинамічно значущих шунтів і наявність ембріональних шляхів кровообігу (аранцієва і боталова протоки, овальний отвір та ін.), які забезпечують функціонування системи кровообігу:
а) кровоплин через артеріальну протоку, напрямок справа-наліво, складає 60%) від загального серцевого викиду,
б) функціонування право-лівого шунта, зумовлене більш високою резистентністю легеневої артерії відносно аорти, незважаючи на однакові значення тиску (70/45 мм рт. ст.);
8) тиск у правому передсерді незначно переважає над тиском у лівому передсерді;
9) плацентарна кров насичена киснем на 70% і має кисневий тиск 28-30 мм рт. ст.;
10) незначні зміни властивостей крові спостерігаються у лівому передсерді, насичення крові киснем складає 65%, тобто незначно перевищує у правому передсерді — 55%). Тиск кисню у лівому передсерді складає 26 мм рт. ст., на відміну від тиску в правому передсерді — 16-18 мм рт. ст.;
11) тиск кисню в головному мозку та міокарді відносно вищий;
12) плацентарний кровоплин поділяється на два потоки:
а) через венозну протоку,
б) через печінку, переважно у лівій частці;
13) плацентарний кровоплин характеризується більш високою швидкістю та низькою резистентністю судинного русла, даний кровоплин відповідальний за обмін кисню на вуглекислий газ, служить для доставки поживних речовин до плода. Таким чином, плацента є активним метаболічним органом;
14) легені є цілим органом, в них відбувається витягнення кисню, після народження відбувається зміна метаболічних функцій. Легені на пізніх термінах гестації секретують внутрішньоальвеолярну рідину і виробляють сурфактант;
15) має місце зниження кровоплину через звуження аорти;
16) попадання крові в правий шлуночок та легеневу артерію відбувається через верхню порожнисту вену і коронарний синус.
Внутрішньоутробна гіпоксія плода може бути частішою, ніж її ознаки, що виявляються при простому клінічному огляді, може зумовлювати багато патологічних станів новонародженого.
Помірна гіпоксія та гіперкапнія можуть викликати перерозподіл фетальної циркуляції з посиленням церебрального і коронарного кровоплину, за рахунок впливу на аортальні барорецептори, чутливі до тиску кисню та вуглекислого газу.
Виражена гіпоксія викликає значний перерозподіл кровоплину та зміну запобіжного кровоплину. Поєднання гіпоксії, ацидозу та гіперкапнії є причиною зниження легеневого і плацентарного кровоплину, в основному, пропорційно плину у верхніх та нижніх порожнистих венах через овальне вікно, що більш відповідає кровоплину через венозну протоку, зменшення кровоплину в черевному стовбурі, інтерстиціальному тракті та нирках.
Периферичний кровоплин може контролюватися пасивно чи меншою мірою за рахунок певних медіаторів. Серед них ендорфіни, аргінін, вазопресин, катехоламіни, що мають значну дію, яка до цього часу остаточно не вивчена.
Коливання частоти скорочень серця плода під час впливу гіпоксичного стресу та маткових скорочень мають пристосувальний характер і призводять до дистресу плода.
З кінця 2-го місяця внутрішньоутробного періоду встановлюється плацентарний кровообіг (рис. 33). Кров, насичена киснем і поживними речовинами, надходить від матері до плода по пупковій вені, яка відходить від плаценти і міститься в пупковому канатику разом з двома пупковими артеріями. Після проходження через пупкове кільце плода пупкова вена ділиться. Кілька її гілочок ідуть до печінки, а основна її частина продовжується у вигляді аранцієвої протоки, що впадає в нижню порожнисту вену, в яку вливається венозна кров від нижньої половини тіла.
Відносно багата на кисень кров нижньої порожнистої вени надходить у праве передсердя, далі з нього через овальний отвір — в ліве передсердя, лівий шлуночок і аорту, а з неї — до всіх органів і тканин. У ліве передсердя надходить Дуже невелика кількість венозної крові від легеневих вен з легень, які не функціонують, що істотно не позначається на газовому складі крові лівого передсердя. У праве передсердя, крім нижньої порожнистої вени, впадає верхня порожниста вена, яка несе венозну кров з верхньої половини тіла.
З правого передсердя кров надходить у правий шлуночок і потрапляє в легеневу артерію. Лише незначна частина цієї крові надходить у мале коло кровообігу і по легеневих венах повертається у ліве передсердя. Більша частина крові з легеневої артерії через відкриту артеріальну протоку вливається в кінцеву частину аортальної дуги і опиняється майже повністю в нисхідній аорті.
Венозна кров збирається в пупкових артеріях, які піднімаються до задній поверхні передньої черевної стінки, проходить через пупкове кільце і через пуповину досягає плаценти, в якій здійснюється газообмін.
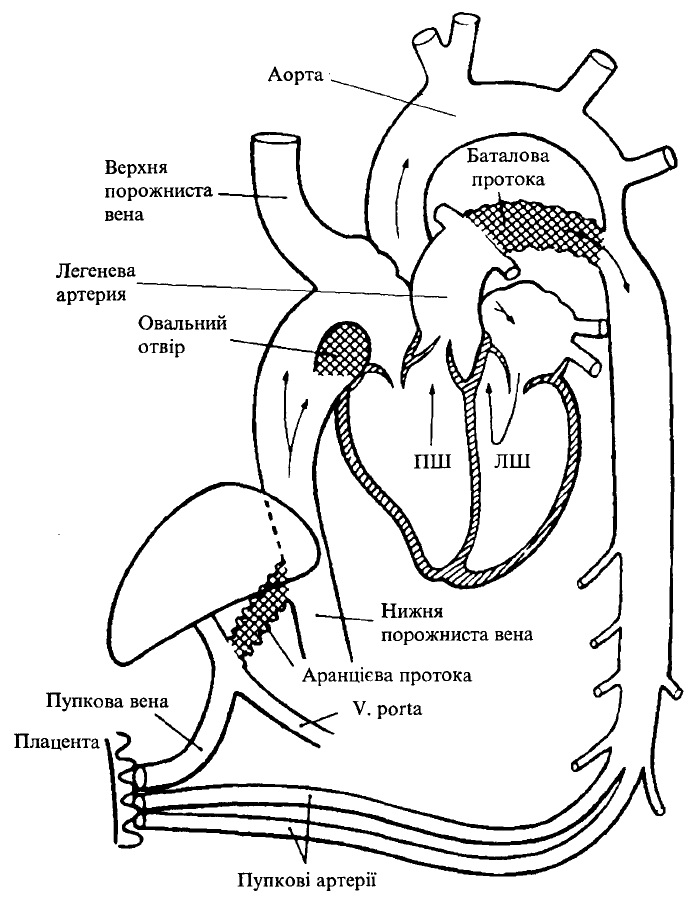
Рис. 33. Схема кровообігу плода
Таким чином, плацентарний кровообіг забезпечує найбільшу оксигенацію печінки і верхньої половини тіла плода (в межах 67-80Vo).
Після народження спостерігається перебудова системи кровообігу. Відбувається перехід від плацентарного газообміну до легеневого. Починає
функціонувати мале коло кровообігу і спостерігається запустіння пупкової вени, яка пізніше перетворюється на круглу зв’язку печінки, пупкових артерій, з яких утворюються зовнішні міхурево-пупкові зв’язки.
В перші години значно збільшується легеневий кровоплин, що разом з першим вдихом приводить до великого легеневого венозного повернення, що відповідає розтягненню лівого передсердя. Подальше збільшення тиску в лівому передсерді при збільшенні кровоплину є реакцією-відповіддю на наростання місцевого гемодинамічного навантаження у лівому шлуночку внаслідок усунення з кровообігу слаборезистентної плаценти. Наступне припинення умбілікального венозного плину приводить до зменшення тиску в правому передсерді, що відповідає ступеню закриття овального вікна клапаном. Це закриття не закінчене і передбачає потенціальне функціонування право-лівого шунтування, особливо поєднано з обільним аорто-легеневим скиданням крові через артеріальну протоку.
На 2-му тижні після народження починається зрощення заслінки з краєм овального отвору. Анатомічно овальний отвір заростає на кінець 5-7-го місяця життя.
У 50% здорових дітей право-ліве шунтування через овальне вікно епізодично функціонує від 8 днів до року життя. У решти 50% дітей функціонування овального вікна продовжується до 5 років, у 25% з них відкрите овальне вікно зберігається і в дорослому віці. У більшості випадків відкрите овальне вікно спостерігається без гемодинамічного функціонування, що дозволяє віднести дане анатомічну утворення до групи малих аномалій розвитку.
З перших хвйлин життя дитини запустіває аранцієва протока, а повна її облітерація закінчується в кінці 8-го тижня життя.
З першим криком настає спазм боталової протоки, але вона протягом 8 год. продовжує функціонувати. Анатомічна облітерація боталової протоки закінчується на 6-8-му тижні постнатального періоду. Закриття артеріальної протоки відбувається під впливом рівня рО, крові новонародженого, що підвищується, відносно плода. Однак, пропонуються інші механізми закриття протоки, скажімо, вплив брадикінінів, простагландинів та автономних неврологічних ефектів.
Незважаючи на точний і вивірений механізм фізіологічного закриття артеріальної протоки, існують певні фактори, які контролюють даний процес – стан легеневих судин (резистентність малого кола кровообігу), фармакологічний стан простагландинів та неординарні клінічні прояви.
Закриття артеріальної протоки у новонароджених можливе при застосуванні індометацину, який блокує синтез простагландинів, що підтверджено експериментальними дослідженнями. Для запобігання закриттю протоки проводиться внутрішньовенне введення розчинів простагландинів (PGE,).
Поява ефекту від рО і простагландинів є віковозалежним фактором і, в основному, відбувається у пізні терміни гестаціїта ранні періоди позаутробного життя.
В деяких випадках після народження не відбувається закриття і облітерації ембріональних шляхів кровообігу. Це також спричиняє формування вроджених вад серця і судин, таких як відкрита боталова протока, дефект міжпередсердної перегородки та ін.
Великих змін зазнає портальна циркуляція, відбувається перерозподіл кровоплину. Припиняється кровопостачання найбільш оксигенізованою кров’ю лівої частки печінки, заміщуючись на слабо оксигенізовану портальну венозну кров. Мозковий кровоплин, користуючись перевагою у плода, збільшується у періоді новонародженості для нівелювання післяпологової асфіксії та збільшеного рівня рСОг Церебральний неонатальний кровоплин зменшується після періоду новонародженості з одночасним зменшенням наявного вираженого ліво-правого шунтування через артеріальну протоку.
Кровоплин у верхньо-брижовій артерії, що відходить від черевного стовбура, зменшується упродовж нормального періоду новонародженості. Даний кровоплин піддається впливу таких факторів, як метаболічний ацидоз, переповнення і розтягнення шлунка, геморагії в шлунково-кишковому тракті, що мають місце у новонароджених з проявами некротичного ентероколіту.
Параметри, властиві перехідній циркуляції, зазнають впливу численних факторів. У періоді новонародженості виражений вплив на якість перехідного типу гемодинаміки має час накладення акушерських скобок на пуповину. Тривалість даного часу має значний вплив на тривалість перехідного періоду до нормального функціонування власної гемодинаміки новонародженого. У деяких дослідженнях наводяться порівняння раннього накладення скобок на пуповину (5-30 с після пологів) з більш пізнім (понад 3 хв.). Отримано достовірну різницю щодо частоти зменшення тиску в легеневій артерії та зміни ЕКГ-параметрів. Трансфузія плаценти при більш пізньому накладенні скобок на пуповину доставляє в басейн новонародженого на 60% більше крові, ніж при ранньому накладенні. Даний додатковий об’єм крові забезпечує як праве, так і ліве передсердя додатковим об’ємом (так званий плюс-об’єм), зумовлюючи більш високий середній тиск. Середній передсердний тиск за результатами проведеного дослідження досягає вихідного рівня упродовж 2-3 годин. При підвищеній в’язкості крові зменшення додаткового об’єму і нормалізація передсердного тиску до вихідного рівня, особливо у дітей з більш пізнім накладенням скобок на пуповину, не досягає відповідного рівня навіть після того, як минуло 10 год. після пологів. Артеріальний легеневий тиск нормалізується своєчасно.
Таким чином, основні гемодинамічні характеристики новонароджених, отримані при катетеризації серця, полягають в наступному:
1) знижена резистентність легеневого судинного русла, відмічається збільшення легеневого кровоплину;
2) легеневий артеріальний тиск набагато менший, ніж системний артеріальний тиск;
3) овальне вікно закрите;
4) артеріальна протока закрита;
5) усунення плацентарного кровоплину, спустіння плацентарних
комунікацій;
6) серце починає працювати послідовно, увесь основний викид правого шлуночка відбувається через легені (мале коло кровообігу), викид лівого шлуночка — через велике коло кровообігу (кожен шлуночок окремо накачує 50% загального серцевого викиду);
7) системний артеріальний тиск і периферична резистентність судин великого кола кровообігу мають більше значення, ніж тиск у легеневій артерії та резистентність легеневих судин;
8) перехідний період циркуляції існує за часом між двома порівнюваними варіантами циркуляції, залежить від часового впливу.
У більшості випадків відмічено збіг різних норм, умов неонатальної циркуляції в ранні періоди життя. Основними умовами, які властиві та/або можуть впливати на включення перехідної циркуляції (гемодинаміки), є:
1) посилення кровоплину в малому колі кровообігу;
2) закриття венозної й артеріальної проток, овального вікна, усунення шунтування крові через дані утворення;
3) усунення функціонування плаценти. Плацентарна трансфузія припиняє перев’язування чи накладення закріпки на пуповину після ефективного легеневого обміну.
Багато факторів впливають під час перехідної гемодинамічної адаптації, основними з яких є: зрілість серцево-судинної системи, пренатальна і постнатальна асфіксія, гестаційні фактори, несприятливі випадки під час вагітності, тип пологів (вагінальний чи кесарів розтин), а також підвищення тиску в порожнинах серця.
Дані гемодинамічні зміни перехідної циркуляції супроводжуються серцевими шумами, які вислуховуються у більшості новонароджених — 85%. Ці шуми зумовлені тимчасовим функціонуванням упродовж перших 8 годин у нормальних новонароджених артеріальної протоки з ліво-правим шунтуванням. Окремі шуми виникають в ранню та пізню систолу, реєструються при аускультації та на фонокардіограмі.
Серцево-судинна система в процесі росту і розвитку зазнає значних змін.
Серце новонародженого займає досить значний об’єм грудної клітки і більш високе положення, ніж у дорослого, що пов’язано з високим стоянням діафрагми. Серце за формою наближається до округлої або навіть кулястої. Через високе стояння діафрагми воно набуває лежачого положення, а на рентгенограмі тінь серця має форму косо розташованого овалу. В задній проекції серце розташоване між IV-VII грудними хребцями, а його передня проекція залежить від віку дитини.
Положення серця з віком дитини стає вертикальним. Зміна форми і положення серця спричиняє зміщення верхівкового поштовху. У новонароджених і дітей перших двох років життя верхівковий поштовх пальпується в IV міжребер’ї на 1-2 см назовні від лівої серединно-ключичної лінії (lin.medioclavicularis sinistra), у віці 3-7 років — в V міжребер’ї на 1 см назовні від лівої серединно-ключичної лінії, а в віці 7-12 років — в V міжребер’ї на 0,5 см усередину від лівої серединно-ключичної лінії, тобто, так як у дорослих.
Особливості форми серця обумовлені не тільки його положенням, але й особливостями співвідношення розмірів передсердь і шлуночків. Серце новонародженого має відносно більші розміри передсердь і недостатньо розвинені шлуночки. Причому праве передсердя більше за ліве. Особливо недорозвинена стінка лівого шлуночка. Це проявляється тим, що товщина стінок правого і лівого шлуночків у новонароджених однакова (співвідношення їх товщини 1:1). З віком збільшується навантаження на лівий шлуночок, зростає робота, яку він виконує, і більш інтенсивно збільшується товщина стінки. Наприкінці першого року життя переважає товщина стінки лівого шлуночка і співвідношення товщини стінки правого і лівого шлуночків дорівнює 1:1,5, в 5 років — 1:1,5, а в 14 років —1:2,76. За весь період дитинства товщина стінки лівого шлуночка збільшується в 3 рази, тоді як товщина правого шлуночка — лише на третину.
У новонароджених спостерігається відносно більша маса серця по відношенню до його маси тіла, ніж у дорослого. Вона становить 0,8% маси тіла, тоді як у дорослого — тільки 0,4%. В міру росту дитини відбувається збільшення маси серця: до 8 міс маса серця подвсзюється, до 3 років — потроюється, а до 15 років — зростає в 10 разів. Важливо відзначити, що відношення маси серця і маси тіла збільшується нерівномірно. У віці 5-6 міс спостерігається мінімальна маса серця по відношенню до маси тіла (0,38%), що зберігається також у хлопчиків віком 8 років (0,44%) і у дівчаток віком 12 років (0,48%). Саме в ці вікові періоди потрібно уважно стежити за фізичними і психоемоційними навантаженнями, оскільки можливі різні ускладнення та захворювання серця дитини.
Міокард у новонароджених має ознаки ембріональної будови і являє собою недиференційований симпласт з багатою васкуляризацією. Він має пухку будову, м’язові волокна тонкі, міофібрили погано розділені і містять велику кількість овальних ядер, поперечна смугастість відсутня. Сполучна тканина міокарда виражена слабо, еластичних елементів практично немає. Вони з’являються лише після 7-річного віку. Для міокарда дітей раннього віку характерне багате кровопостачання і судинна сітка його тим більша, чим менший вік дитини. Міокард передсердь значно тонший, ніж шлуночків. Нервова регуляція серця недосконала, що обумовлює досить часті дисфункції у вигляді ембріокардії, екстрасистолії та дихальної аритмії.
З віком з’являється поперечна смугастість міофібрил, інтенсивно розвивається сполучна тканина, м’язові волокна потовщуються, і до початку періоду статевого дозрівання розвиток міокарда, як правило, закінчується.
Серце плода у відповідь на стресовий вплив реагує збільшенням серцевого викиду з одночасним почастішанням його частоти. Збільшення ударного об’єму запізнюється, згідно з законом Франка-Старлінга — сила скорочення знижена, порівняно з більш розвинутим серцем.
Серце плода споживає глюкозу як основне джерело енергії. Шлях метаболізування жирних кислот, властивий дорослому серцю, як найбільш енергетично ефективний, — практично не функціонує. Гіпоглікемія зумовлює виражену загрозу для функціонування серця плода через те, що воно покладається на глюкозу як на енергетичний субстрат.
Характеризуючи функціональні особливості серцево-судинної системи у дитячому віці, потрібно відзначити, що у новонароджених значно менша ударна ємність і хвилинна ємність серця, ніж у дорослих (табл. 29). Так, у новонароджених ударна ємність серця становить 2,5-3 мл, хвилинна ємність серця — 340 мл, тоді як у дорослих — відповідно 60-80 і 3100-5200 мл. Причому важливо, що відносна ударна ємність серця (на 1 кг маси тіла) у дітей не менша, а відносна хвилинна ємність серця навіть більша, ніж у дорослих. В кінці Першого року життя відносна ємність серця становить 120 мл/кг, в 5 років — 100 мл/кг, в 10 років — 80 мл/кг, а у дорослих — 60-70 мл/кг. Фізіологічна суть Цього полягав в тому, що завдяки високій відносній хвилинній ємності серця забезпечується потреба тканин організму в кисні і поживних речовинах.
З віком, в міру росту і розвитку міокарда, ці показники зростають. Але хвилинна ємність серця зростає повільніше, ніж ударна ємність, внаслідок зменшення з віком частоти скорочень серця (ЧСС). Взагалі для дітей характерна більша ЧСС. У новонароджених ЧСС становить 140-160 за 1 хв., в 6 міс. — 130-135, в 1 рік — 120-125, в 5 років — 100, в 10 років — 80-85, старше 12 років — 70-75 за 1 хв., а у дорослих — 65-75 за 1 хв. Більш детально характеристика частоти скорочень серця залежно від віку представлена в табл. 30.
Таблиця 29. Вікові показники ударного (УО) і хвилинного (ХОК) об´ємів крові
| Вік | УО | ХОК | ||
| Абсолютна
величина, мл |
Відносна
величина, мл/кг |
Абсолютна
величина, мл |
Відносна
величина, мл/кг |
|
| Новонароджений
1 рік 1-5 років 6-9 років 10-13 років 14-15 років Дорослий |
2,5-3,5
1 10,5 1 19 1,2 23-25 1,1 37-44 1,1 59 1,1 60-80 1 |
340-490 140
1250 126 1995 124 2500 114 3200 80 4300 78 3100-5200 70 |
||
Таблиця 30. Частота скорочень серця (пульсу) у дітей різного віку
| Вік дитини | Частота пульсу за 1 хв |
| Новонароджений | 140-160 |
| 6 міс. | 130-135 |
| 1 рік | 120-125 |
| 2 роки | 110-115 |
| 3 роки | 105-110 |
| 5 років | 100 |
| 8 років | 90 |
| 10 років | 80-85 |
| 12 років і старше | 70-75 |
У зв’язку з більшою ЧСС для новонароджених і дітей раннього віку характерно зменшення тривалості серцевого циклу. У новонароджених тривалість серцевого циклу дорівнює 0,4-0,5 с. З віком вона подовжується і в 10-річному віці становить 0,7 с, у дорослих — 0,77-0,8 с. Тривалість серцевого циклу збільшується за рахунок діастоли шлуночків, яка у дорослих (0,48 с) приблизно в 2 рази триваліша, ніж у грудних дітей (0,23 с), що дозволяє шлуночкам наповнюватись більшою кількістю крові.
Кровообіг у новонароджених здійснюється вдвічі швидше, ніж у дорослих. Повний кругообіг крові у новонароджених становить 12 с, у 3-річних дітей — 15 с, а у дорослих — 22 с. Це забезпечує більше кровопостачання органів дитячого організму. Лінійна швидкість кровотоку в різних відділах судинної системи наведена в табл. 31.
Таблиця 31. Лінійна швидкість кровотоку в судинах у дітей
| Судини | Швидкість, мм/с |
| Аорта | 500-600 |
| Артерії | 150-200 |
| Артеріоли | 5 |
| Капіляри | 0,5 |
| Середні вени | 60-14 |
| Порожнисті вени | 180-200 |
Величина артеріального тиску (AT) у дітей нижча, ніж у дорослих. Це обумовлено меншою скоротливою здатністю серця, відносно більшим просвітом артерій і недостатнім розвитком еластичних волокон артерій. При народженні у дитини максимальний AT становить 76 мм рт.ст. і збільшується щомісяця на 2 мм рт.ст. Тому у дітей першого року життя величину максимального AT можна визначити за формулою: 76 +/^п, де п — кількість місяців життя.
Наприкінці першого року життя величина максимального AT становить 90 мм рт.ст. і в подальшому зростає щорічно на 2 мм рт.ст. Виходячи з цього, у дітей, старших року, величину максимального AT можна визначити за формулою: 90 + ?п, де п — кількість років дитини.
Величина мінімального AT становить 1/2-2/3 максимального.
Останнім часом, для оцінки AT у дітей залежно від віку і статі, а також для більш точної діагностики артеріальної гіпертензії використовують центильний метод.
Згідно з рекомендаціями ВООЗ, гіпертензію діагностують на основі перевищення величини нормального AT у дітей різного віку (табл. 32).
Таблиця 32. Граничні величини максимального і мінімального артеріального тиску у дітей різного віку
| Вік | Артеріальний тиск, мм рт.ст. | |
| Мах | Міп | |
| До 7 днів | 96 | – |
| 8 днів – 1 міс | 112 | 74 |
| 3-5 років | 116 | 76 |
| 6-9 років | 122 | 78 |
| 10 – 12 років | 126 | 82 |
| 13 – 15 років | 136 | 86 |
На момент народження дитини його артеріальна система досить сформована. Венозна система новонародженого менше диференційована, але з віком вона інтенсивно розвивається. Відмінності судин дитини і дорослого полягають в наступному.
Артерії у дітей відносно ширші, ніж у дорослих, причому вони навіть дещо ширші, ніж просвіт вен. Але оскільки з віком вени ростуть швидше, ніж артерії, то до 15-річного віку просвіт вен стає вдвоє більший, ніж артерій. У дітей добре розвинена капілярна сітка. Причому у дітей раннього віку капіляри кишок, нирок, легень і шкіри не тільки відносно, але й абсолютно ширші, ніж у дорослих. Кровоносні судини мають тонкі стінки, в них недостатньо розвинені м’язові та еластичні волокна. З віком в структурі судин збільшується кількість еластичних і м’язових елементів. Розвиток судин в основному завершується до 12 років.
Досить важливим методом дослідження стану серцево-судинної системи є електрокардіографія. Електрокардіограма (ЕКГ) здорових дітей відрізняється від ЕКГ дорослих і, крім того, має свої специфічні особливості у кожному віковому періоді. Ці особливості зумовлені різним анатомічним положенням серця в грудній клітці, різним співвідношенням м’язових мас правого та лівого шлуночків, вегетативними і ендокринними впливами та іншими, ще не повністю вивченими, факторами. Для дітей, особливо молодшого віку, характерна виражена лабільність пульсу, менша тривалість інтервалів та зубців.
У здорових дітей часто можна спостерігати синусову, дихальну аритмію: у фазі вдиху число серцевих скорочень збільшується, а у фазі видиху — зменшується. Аналіз ЕКГ-даних свідчить, що синусова аритмія того чи іншого ступеня вираженості спостерігається у 94% дітей і це явище притаманне здоровим дітям усіх вікових періодів, у тому числі й дітям до року та віком від 1 до 2 років. У більшості дітей відмічається помірно виражена синусова аритмія. Виражена синусова аритмія спостерігається з однаковою частотою (20%) у дошкільному та шкільному віці. Різко виражена дихальна аритмія зустрічається уже у дітей дошкільного віку, найчастіше у віці 3-7 років (12%) та 13-14 років (13%).
Тривалість зубців та інтервалів ЕКГ у дітей коротша, ніж у дорослих. Часто зустрічаються негативні зубці Т у III та правих грудних відведеннях (іноді до лівого відведення V4), деформація початкового шлуночкового комплексу QRS у вигляді букв W чи М у III відведенні. Розщеплення комплексу QRSv, у здорових дітей або при патології позначають як «синдром сповільненого збудження правого надшлуночкового гребінця» або «неповна блокада правої ніжки пучка Гіса». Походження цього феномена остаточно не з’ясоване. Крім зазначених причин, має також значення положення серця в грудній клітці та взаємний вплив потенціалів міокарда правого і лівого шлуночків. У здорових дітей можуть реєструватися негативні, двофазні чи згладжені зубці Р у ПІ відведенні. Нерідко можна спостерігати, особливо у дітей раннього віку, високі загострені зубці Р, глибокі зубці Q у II і III стандартних відведеннях (рис. 34).
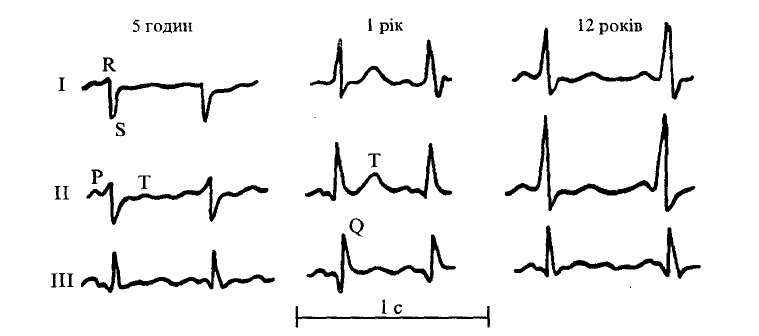
Мал. 34. ЕКГ у дітей різного віку.
I, ІІ, III — номери стандартних відведень ЕКГ
У II і III відведеннях може спостерігатися розщеплення або вузлуватість зубця Р за рахунок фізіологічної асинхронії збудження правого (раніше) та лівого (пізніше) передсердь (рис. 34).
З віком дітей змінюється тривалість інтервалів R-R, P-Q, Q-T, ширина шлуночкового комплексу QRS (табл. 33). Чим молодша дитина, тим частіший ритм серцевих скорочень і тим коротші інтервали ЕКГ.
Таблиця 33. Вікові зміни тривалості інтервалів і комплексів ЕКГ (в сек)
| Вік | PQ | QRS | от | R-P |
| Новонароджені | 0,110 | 0,044 | 0,260 | 0,420 |
| 1-11 місяців | 0,115 | 0,048 | 0,258 | 0,470 |
| 1 – 2 роки | 0,117 | 0,048 | 0,290 | 0,530 |
| 6 -7 років | 0,127 | 0,057 | 0,300 | 0,710 |
| 12 років | 0,135 | 0,070 | 0,330 | 0,810 |
| Дорослі | 0,150 | 0,080 | 0,350 | 0,830 |
З віком змінюється і висота окремих зубців ЕКГ у різних відведеннях, особливо висота зубців R і S, але діагностичне значення має не абсолютна висота зубців, а їх співвідношення у різних відведеннях. Воно залежить від Напрямку ЦОС. Вікова динаміка співвідношення амплітуди зубців R і S виражається в тому, що у стандартних відведеннях з віком дитини амплітуда зубця R збільшується у І відведенні і зменшується в III; амплітуда зубця S, навпаки, зменшується в І і збільшується в III відведенні, що зумовлено зміною Напрямку ЕОС (табл. 34). В грудних відведеннях амплітуда зубця R у відведеннях VI і V2 з віком зменшується, амплітуда зубця S — збільшується. У відведеннях V 4-6 амплітуда зубця R дещо збільшується, що пов’язано зі змінами співвідношення мас лівого і правого шлуночків та поворотами серця навколо своєї осі.
Таблиця 34. Вікові зміни співвідношення амплітуд зубців ЕКГ
| Вік | R : Р | 1 R: Т |
| Новонароджені | 3 | 6 |
| До 2 років | 6 | 3-4 |
| 3 -7 років | 8-10 | 3,5 – 3,7 |
| 7-12 років | 8-10 | 3-4 |
| Дорослі | 8 | 4 |
Характерним для ЕКГ дітей є також вертикальний напрямок ЕОС, що часто зустрічається, особливо у новонароджених та дітей раннього віку. Тривалість активації шлуночків в правих грудних відведеннях з віком зменшується, а в лівих — збільшується.