У дитячому віці білковий обмін, як і інші види обміну речовин, має певні характерні особливості. Перш за все це те, що процеси асиміляції домінують над процесами дисиміляції, хоча в період новонародженості має місце фізіологічна недостатність катаболізму білків у кишках та печінці.
Білок є одним з основних і життєво необхідних продуктів. В організмі людини запасів білка немає. Тільки при розпаді тканин білки розщеплюються в них з вивільненням амінокислот, які витрачаються на підтримку білкового складу інших більш життєво важливих тканин і клітин. Тому нормальний ріст організму без достатньої кількості білка неможливий, оскільки жири і вуглеводи не можуть їх замінити. Крім того, в білках містяться незамінні амінокислоти, необхідні для формування заново утворюваних тканин або для їх самооновлення. Білки є складовою частиною різних ферментів (травних, тканинних тощо), гормонів, гемоглобінів, антитіл. Підраховано, що близько 2% білків м’язової тканини є ферментами, які постійно оновлюються. Білки виконують роль буферів, беручи участь у підтримці постійної реакції середовища в різноманітних рідинах (плазма крові, спинномозкова рідина, кишкові секрети тощо). Нарешті, білки є джерелом енергії: 1 г білка при його повному розпаді утворює 16,7 кДж (4 ккал). Однак на даний час стало очевидно, Ш0 використання білка для енергетичних затрат не є нормальним, оскільки в результаті розпаду амінокислот утворюється багато кислих радикалів і аміаку, які не байдужі для організму дитини.
Білки їжі, перед тим як бути використаними організмом для побудови вищих тканинних білків, розщеплюються в травному каналі ферментативним шляхом до амінокислот. З амінокислот в клітинах синтезуються специфічні для даного виду організму білкові речовини.
Активність перетравлювання білків у шлунку дітей, особливо раннього віку, знижена. У новонароджених недостатньо диференційований слизовий епітелій, менший розмір шлунка, і секреторна функція головних клітин — основних продуцентів пепсину — знижена.
Разом з тим у дітей відбувається пептичне перетравлення певної частини білків молока. Вироблення і активність пепсину у дітей залежать від віку, стану здоров’я, конституційних особливостей, способу вигодовування та інших факторів. У грудних дітей активність пепсину коливається від 2 до 16 од., рідко досягаючи 32 од., у дітей старшого віку вона становить 16-32 од.
Функція секреції соляної кислоти обкладочними клітинами для шлунка в повному обсязі розвивається пізніше, хоча секреція іонів хлору відмічається вже на момент народження. У дітей грудного віку менш кисла реакція середовища, pH коливається в межах 5,8-3,8. Звідси зрозуміло, що процес активації пепсину і умови його функції не відповідають оптимальним, внаслідок чого і пептичне перетравлення білків у шлунку знижено.
Виділення шлункового соку у дітей в основному має такі ж фізіологічні закономірності, як і у дорослих. У новонародженого шлунковий сік містить всі основні органічні (муцин, білок) і неорганічні (НС1 та NaCl) сполуки, що виявляються у шлунку дорослих. Серед ферментів у шлунку навіть дітей раннього віку визначається пепсин та гастриксин.
Якщо дітей грудного віку годують жіночим молоком, то шлунковий сік виділяється з найменшою кислотністю та активністю ферментів, однак його цілком достатньо для перетравлення молока. При вигодовуванні коров’ячим молоком виділяється сік зі значно більшою кислотністю і більш значним вмістом всіх основних ферментів.
У шлунку дітей раннього віку виявлена наявність хімозину, який забезпечує зсідання молока і може діяти не лише при оптимальному pH, але й в нейтральному і навіть слаболужному середовищі, правда, з меншою ефективністю. У дітей перших місяців життя активність хімозину становить 16-32 од., зростаючи до кінця першого року життя до 256-512 од. і залишаючись на цьому рівні у дітей старшого віку.
У дітей грудного віку продукується ренін. В присутності Са2+ він сквашує Молоко. Встановлена наявність у дітей катепсину-протеази з оптимальною дією PH 5-6.
Таким чином, в шлунку відбувається перетравлення харчових білків, причому активність цього процесу залежить від віку, характеру вигодовування та якості харчування. У дітей раннього віку пептичне перетравлення відбувається менш інтенсивно, але з віком активність цього процесу зростає. В 10-13 років перетравлення білків у шлунку здійснюється так само, як і у дорослих.
У грудних дітей білки збільшують тривалість знаходження їжі в шлунку, і у підлітків сильніше виявляється гальмуюча дія жирів.
Перетравлення білків закінчується в тонкій кишці під впливом ферментів, що виділяються підшлунковою залозою та клітинами кишечника.
У підшлунковій залозі синтезуються три ендопептидази: а) трипсин, що має пептидні зв’язки, утворені лізином або аргініном; б) хімотрипсин, що діє на пептичні зв’язки за участю фенілаланіну, триптофану, тирозину; в) еластаза, що гідролізує пептичні зв’язки, утворені гліцином, аланіном, серином.
Профермент трипсину — трипсиноген — активується ферментом ентерокіназою шляхом часткового протеолізу (від трипсиногену відщеплюється пептид, до складу якого входить шість амінокислот). Хімотрипсин активується трипсином. Підшлункова, залоза продукує також в неактивній формі ферменти карбоксипептидази. Це екзопептидази, які відщеплюють від поліпептиду С-кінцеву амінокислоту. В активну форму фермент перетворюється під впливом трипсину. Слизова оболонка кишечника виділяє також амінопептидази (вони відщеплюють N-кінцеву амінокислоту від пептидів) та діпептидази, що гідролізують діпептиди.
Секреція ферментів регулюється тканинними гормонами, які утворюються в слизовій оболонці травного каналу. Стимулом для виділення цих гормонов є їжа; серед них найбільш вивчені гастрин шлунка (підсилює секрецію НС1), секретин дванадцятипалої кишки (гальмує секрецію НС1) та холецистокинін дванадцятипалої кишки (підсилює виділення жовчі та панкреатичного соку).
У кишечнику всмоктуються продукти гідролітичного розщеплення білків, що вже втратили видову та тканинну специфічність, тобто амінокислоти і, можливо, найпростіші пептиди. Амінокислоти всмоктуються шляхом активного транспорту. Існують п’ять систем всмоктування амінокислот. Амінокислоти, що всмокталися, поповнюють пул амінокислот в організмі.
У дітей перших місяців життя знижена секреція підшлункового соку і панкреатичних ферментів. Вироблення трипсину в цей період знижено; воно підвищується до кінця першого року життя і значно зростає у 2-3 роки.
Для задоволення потреб організму суттєвим є не лише кількість білка, але і його якісний склад. Відомо, що 8 амінокислот є незамінними (тобто такими, що не можуть синтезуватися в організмі і тому обов’язково мають надходити з харчовими білками) в будь-якому віці. Це лейцин, ізолейцин, лізин, метіонін, фенілаланін, треонін, триптофан і валін. Крім того, у дітей до 5 років незамінною амінокислотою є також гістидін, у дітей перших трьох місяців цистин та цистеїн, оскільки синтез двох останніх з метіоніну різко зниженИИ внаслідок недостатності цистатіонази. Цим і пояснюється цистинурія у недоношених. Таким чином, 10 амінокислот для дітей є життєво важливими.
Потреба дітей в амінокислотах не тільки вища, але й амінокислотний склад інший, ніж у дорослого. Особливо велика потреба в лейцині, фенілаланіні, лізині, валіні, треоніні. Це необхідно враховувати при складанні харчування дітей, особливо раннього віку. Тільки завдяки поступовому дозріванню ферментних систем в процесі росту потреба дітей в незамінних амінокислотах поступово знижується. В той же час при надмірному білковому перевантаженні у дітей легше, ніж у дорослих, виникає аміноацидемія, що може проявитися затримкою розвитку, особливо нервово-психічного.
Для вивчення білкового обміну вже багато років використовують критерій балансу азоту. Для цього визначають кількість азоту, що надходить з їжею, і кількість азоту, яка виділяється з фекальними масами і сечею. За втратою азотистих речовин з калом визначають ступінь перетравлення білка і його резорбції в тонкій кишці. За різницею між азотом їжі і її виділенням з фекаліями і сечею міркують про ступінь його споживання для формування нових тканин або для їх самооновлення.
У дорослої людини, як правило, кількість виведеного азоту звичайно дорівнює кількості азоту, що надійшов з їжею. У новонароджених може мати місце негативний азотний баланс, котрий протягом декількох днів змінюється на позитивний, який і зберігається увесь період росту і розвитку дитини. Тобто, на відміну від дорослих, у дітей має місце позитивний азотний баланс, а саме кількість азоту, що надійшла з їжею, завжди перевищує його втрату з фекальними масами і сечею.
Ретенція харчового азоту, а отже його утилізація в організмі залежить від віку. Хоч здатність до ретенції з їжі зберігається протягом усього життя, вона найбільша у дітей. Рівень ретенції азоту відповідає константі росту.
Об’єднана група експертів ФАО/ВООЗ (1971) вважає, що небезпечний рівень споживання білка в перерахунку на білок коров’ячого молока або яєчний білок становить за день 0,57 г на 1 кг маси тіла для дорослого чоловіка і 0,52 г/ кг для жінки. Небезпечний рівень — кількість, необхідна для задоволення фізіологічних потреб і підтримки здоров’я майже всіх представників даної групи населення. Для дітей же небезпечний рівень споживання білка вищий, ніж для Дорослих. Це пояснюється тим, що у дітей самооновлення тканин відбувається більш енергійно, а головне, дитячому організму, що росте, необхідний білок Для утворення нових тканин. Вважають, що у дітей першого року життя самооновлюється близько 0,9 г/кг білка за добу, у дітей передцошкільного віку (1-3 роки) — 0,8 г/кг за добу, у дошкільників і школярів — 0,7 г/кг за добу. Кількість білка, що витрачається на ріст, приблизно становить 1/5 від Щоденного збільшення маси тіла. Враховуючи відносну значущість наведеного Розрахунку, вважаємо, що потреба дітей в білку повинна бути оптимальною, пРи якій відбувається гармонійний розвиток і ріст.
Встановлено, що засвоєння азоту організмом також залежить від кількості і якості білка. Під останнім слід розуміти амінокислотний склад білка, особливо вміст життєво необхідних амінокислот. Потреба дітей в білку і амінокислотах значно вища, ніж дорослої людини. Підраховано, що необхідно приблизно в 6 разів більше амінокислот, ніж дорослому.
В тканинах дитячого організму переважають гідрофільні білки, що швидко оновлюються, і тільки в пубертатному періоді збільшується кількість склеропротеїнів, які відзначаються більш жорсткою структурою та меншою гідрофільністю.
Детальніше зупинимося на білках плазми крові. Оскільки плазма крові — це динамічна система, яка знаходиться у рівновазі з оточуючими тканинами, то її білки виконують ряд дуже важливих функцій (живлення, підтримання pH, осмотичний баланс, регуляція клітинних функцій, транспорт речовин, резерв амінокислот).
Для міркування про білковий обмін використовують ряд показників. Визначення в крові (плазмі) вмісту білка та його фракцій є сумарним вираженням процесів синтезу і розпаду білка.
Концентрація білків плазми крові у дорослих коливається в межах 57-81 г/ л. В дитячому віці білки плазми крові мають певні особливості. Загалом, це величина постійна, але з віком у дітей їх кількість дещо змінюється. Вміст загального білка в сироватці крові у новонародженого нижчий, ніж у його матері, що пояснюється активним синтезом, а не простою фільтрацією білкових молекул через плаценту матері. Вміст загального білка в плазмі при народженні становить 47-65 г/л, у недоношених — менше 50 г/л, причому рівень білка залежить від ступеня недоношеності. Особливо низький вміст а- та (3- глобулінів, до складу яких входять високоспеціалізовані білки.
Концентрація загального білка та білкових фракцій у новонароджених залежить від стану матері при вагітності. У дітей, які народилися від матерів з різними формами пізнього токсикозу, розвивається гіпо- та диспротеїнемія, що проявляється гіпоальбумінемією та підвищенням рівня а,-, а2– та |3- глобулінів. Найбільш виражене зниження синтезу білка та його фракцій, зокрема глобулінів, у дітей, які народилися від матерів з вродженими і набутими вадами серця та недостатністю кровообігу.
Протягом першого року життя відбувається зниження вмісту загального білка в сироватці крові; особливо низькі показники у дітей віком 2-6 тиж., а починаючи з 6 міс. відбувається поступове підвищення його рівня. Проте в молодшому шкільному віці вміст загального білка дещо нижчий, ніж в середньому у дорослих, причому ці відхилення більш чітко виражені У хлопчиків.
Вміст загального білка в плазмі крові дітей, старших року, збільшується переважно за рахунок підвищення рівня альбуміну та у-глобулінів.
Білки плазми крові щоденно оновлюються на 25%. Поверхня білків плазми крові величезна, близько 40 000 м2. Оскільки вони хімічно активні, це створює величезні можливості для різноманітних фізико-хімічних процесів та хімічних реакцій.
Білки плазми крові є генетично детермінованою гетерогеною системою. Це більш ніж 100 білків, що відрізняються за фізико-хімічними та функціональними властивостями: проферменти, ферменти, інгібітори ферментів, гормони, фактори коагуляції та антикоагулянти, транспортні білки, антитіла, антитоксини тощо.
Розглянемо деякі окремі білки плазми крові. Альбуміни — це глобулярні одноланцюгові білки з молекулярною масою 66 000 Da, ізоелектричний стан 7,4, вуглеводів в молекулі немає. Довжина поліпептидного ланцюга — 14 нм, діаметр — 4 нм. їх добра розчинність обумовлена великою щільністю заряду та малою молекулярною масою. До складу молекули альбуміну входить приблизно 580 амінокислот, вона має 17 дисульфідних складающих, легко піддається конформаційним змінам. Цим пояснюється здатність альбуміну виконувати важливі біологічні функції: 1) регуляцію осмотичного тиску (1 г альбуміну зв’язує 18 мл води); 2) транспорт речовин, що погано розчиняються у воді (жирні кислоти, білірубін, стероїдні гормони, тироксин, адреналін, деякі лікарські засоби, кальцій, частково мідь, вітаміни, токсини, всього близько 100 речовин); 3) альбуміни — депо амінокислот.
Ці теоретичні передумови знаходять своє застосування в клініці при лікуванні гіпербілірубінемії, характерної для періоду новонародженості. Для зниження білірубінемії показано введення очищеного препарату альбуміну з метою запобігання токсичної дії на ЦНС — розвитку енцефалопатїї.
Глобуліни залежно від фізико-хімічних та біологічних властивостей поділяють на ряд фракцій: а,-, а2-, Р- і у-глобуліни. Найважливіші функції 0С[- глобуліну: 1) транспорт ліпідів; 2) транспорт тироксину; 3) транспорт гормонів кори наднирників. Основні функції а2-глобуліну: 1) транспорт ліпідів; 2) транспорт міді (церулоплазмін зв’язує Си+ і Си2+).
Глобуліни з високою молекулярною масою (90 000-150 000) є білками, до складу яких входять різні комплекси. До складу а,- і а2-глобулінів входять муко- і глікопротеїди, що відбивається при загальних захворюваннях. Основна частина антитіл належить до у-глобулінів. Більш детальне вивчення (3- глобулінів показало, що вони складаються з різних фракцій, зміна яких властива при ряді захворювань, тобто вони мають і діагностичне значенгія.
Гаптоглобін (Нр) — це білок, котрий здатний зв’язуватися з гемоглобіном (Нв) у співвідношенні 1:1. Ці комплекси утворюються при внутрішньо- судинному гемолізі еритроцитів. Такий комплекс не проходить через ниркову Мембрану і тим самим зберігається залізо. Комплекс Нр+Нв поглинається Клітинами системи макрофагів (ретикулоендотеліальної) та метаболізується.
Гаптоглобін в пуповинній крові визначається лише у 8% новонароджених, але до кінця першого тижня життя він виявляється у всіх дітей.
Рівень церулоплазміну у новонароджених становить 20% материнського рівня. Поступове його збільшення відбувається після 6 міс. життя.
До фракції ^-глобулінів належать різноманітні білки, такі як ліпопротеїн, трансферин (регулює концентрацію вільного заліза в плазмі, а разом з феритином печінки та гаптоглобіном — концентрацію заліза в організмі), С- реактивний білок (білок гострої фази, якого надзвичайно мало у здорових людей і його кількість різко зростає при запаленні, що супроводжується некрозом).
у-глобуліни — це імуноглобуліни, яких існує п’ять класів (A, D, Е, G, М). Вони відрізняються за будовою і здатні взаємодіяти з певними антигенами.
Поряд з низьким вмістом загального білка відмічається і більш низький рівень деяких його фракцій. Відомо, що синтез альбумінів, що відбувається в печінці, становить 0,4 г/кг за добу. При нормальному синтезі і елімінації (альбумін частково надходить в просвіт кишечника і знов утилізується; невелика його кількість виділяється з сечею) рівень альбуміну в сироватці крові, що визначається методом електрофорезу, становить близько 60% білків сироватки крові. У новонародженого процентний вміст альбуміну навіть відносно вищий (приблизно 58%), ніж у його матері (54%). Це пояснюється, очевидно, не тільки синтезом альбуміну плодом, але й частковим транс- плацентарним його переходом від матері. Потім, на першому році життя, відбувається зниження рівня альбуміну паралельно з вмістом загального білка. Аналогічно альбуміну відбувається динаміка вмісту у-глобуліну. Особливо низькі показники у-глобулінів спостерігаються протягом першого півріччя життя. У подальшому відбувається поступове їх підвищення з віком дитини. Вміст же а,-, а,- і (3-глобулінів відносно мало відрізняється від рівня, властивого дорослим.
Дослідження вмісту білка і так званого його спектра, або білкової формули крові, широко застосовується в клініці. При патологічних станах кількість білків в плазмі крові та їх якісний склад змінюються.
Гіперпротеїнемія може мати місце: а) при втраті води (діарея, блювання у дітей); б) при мієломній хворобі (в крові з’являються мієломні білки — це вже парапротеїнемія); в) при макроглобулінемії.
Гіпопротеїнемія розвивається найчастіше за рахунок альбумінів: а) при нефротичному синдромі; б) при ураженні гепатоцитів (гостра атрофія печінки, вірусний гепатит); в) при білковій недостатності (ураженні травного каналу тощо).
В організмі здорової людини переважають альбуміни (близько 60% білка). Співвідношення глобулінових фракцій легко запам’ятати: сс,-глобулінИ складають одну частину, а2 — дві частини, Р-глобуліни — три частини, У´ глобуліни — чотири частини.
При гострих запальних захворюваннях зміна білкової формули крові характеризується збільшенням кількості а-глобулінів, особливо за рахунок СС2– глобуліну, при нормальному або незначно підвищеному вмісті y-глобулінів і зниженій кількості альбумінів. При хронічному запаленні відмічається підвищення вмісту у-глобулінів при нормальному або незначно підвищеному рівні (3-глобуліну, зменшенні кількості альбуміну. Підгостре запалення характеризується одночасним збільшенням вмісту ос- і у-глобулінів при зниженні рівня альбумінів. Поява гіпергаммаглобулінемії вказує на хронічний процес хвороби, гіперальфаглобулінемія — на загострення.
Окремо розглянемо особливості зсідання крові у дітей. Як відомо, цей процес відбувається за типом каскадного механізму. При каскадному типі регуляції перший фермент діє на другий, другий на третій і т.д. Цей механізм забезпечує швидку появу великої кількості активної форми останнього ферменту ланцюга.
Гемостаз — це послідовність дії п’яти ферментів. Кожен з них активує наступним шляхом відщеплення невеликої дільниці пептидного ланцюга (шляхом обмеженого протеолізу).
Існують також механізми, що не дозволяють каскадній реакції вийти з-під контролю. Зокрема, це видалення активованого ферменту з системи (за аналогією з розпадом цАМФ за допомогою ферменту) і наявність ферментативної системи, що розчиняє згусток при заживленні рани.
Існують два шляхи включення каскадного механізму зсідання крові: 1) внутрішній механізм, який запускається внаслідок контакту крові з поверхнею пошкодженого епітелію; 2) зовнішній механізм, який запускається в результаті вивільнення тромбопластину з пошкоджених тканин.
Утворення ряду білкових факторів зсідання крові новонароджених недостатнє, особливо у недоношених дітей. Введення вітаміну К матері до пологів чи новонародженому підвищує вміст протромбіну в крові. У новонароджених з тяжкою асфіксією активність системи коагуляції значно знижена.
Активність фібринолітичної системи у новонароджених вища, ніж у дорослих, і залишається підвищеною у дітей дошкільного віку. Знижена активність коагуляції та підвищена активність фібринолітичної системи є причиною частих геморагій у маленьких дітей.
У сироватці крові новонароджених визначаються всі основні компоненти калікреїн-кінінової системи. В перші 3 дні в крові новонароджених визначається підвищений вміст вільних кінінів, що може бути обумовлено адаптацією організму новонародженого до умов оточуючого середовища. До кінця першого тижня життя активність кініноутворюючих ферментів (калікреїнів) в крові знижується, а кініноруйнуючих ферментів — підвищується. У віці 1-15 років в крові зростають всі компоненти кінінової системи. У віці 15 років активність калікреїну, кініназна активність крові та вміст кініногену Наближуються до рівня дорослих.
В організмі людини білки розщеплюються гідролітично пептидазами до амінокислот, які залежно від потреби використовуються для синтезу нових білків або шляхом дезамінування перетворюються в кетокислоти та аміак. Обмін амінокислот та інших азотвмістних сполук теж має певні вікові особливості.
У дитини обмін амінокислот в печінці відбувається дуже інтенсивно, що забезпечує достатньо високий рівень процесів росту та розвитку. Все це визначає підвищену концентрацію амінокислот крові та сечі, максимальна кількість якої визначається в ранньому віці. До 2 років активність процесів перетворення амінокислот в печінці наближається до такої, як у дорослих. В печінці дітей затримується приблизно в 2 рази більше білка, ніж у дорослих, а його надлишок використовується для утворення енергії. У всіх новонароджених і особливо у недоношених встановлена функціональна незрілість обміну фенілаланіну, тирозину та таурину. У деяких новонароджених виявляється підвищення рівня фенілаланіну в крові та сечі, що може помилково розглядатися як прояв фенілкетонурії. Підвищений рівень оксипроліну в біологічних рідинах опосередковано свідчить про інтенсивність синтезу амінокислот, що входять до складу сполучної тканини.
У перші дні життя дитини відмічається значна варіабельність амінокислотного спектра сироватки крові. Як правило, у здорової доношеної дитини рівень вільних амінокислот в крові та активність ферментів азотистого обміну значно вищі, ніж у його матері. Найбільш високий вміст амінокислот в крові, за винятком лізину та треоніну, спостерігається в перші дні життя дітей. На 8- 10-й день життя рівень більшості амінокислот в крові значно знижується. Значна варіабельність амінокислотного спектра сироватки крові у новонароджених дітей обумовлена, можливо, зміною умов зовнішнього середовища (в тому числі умов їх вигодовування), які є одним з факторів регуляції обмінних процесів. У зв’язку з цим аміноацидурія у дітей вища, ніж у дорослих.
У дітей раннього віку найбільш активний процес біосинтезу глутаміну, що є основним шляхом знешкодження аміаку. Це, ймовірно, пов’язано з підвищеною потребою організму, що росте, в азоті, а також з недостатньою активністю ферментів печінки, що відповідають за синтез сечовини.
У новонароджених в перші дні життя спостерігається фізіологічна азотемія (до 70 ммоль/л). Після максимального підвищення до 2-3-го дня життя рівень азоту знижується і до 5-12-го дня досягає величини дорослого (28 ммоль/л). У недоношених дітей рівень залишкового азоту тим вищий, чим нижча маса тіла дитини. Азотемія в цей період дитинства пов’язана з ексикацією і недостатньою функцією нирок.
Вміст білка в їжі суттєво впливає на рівень залишкового азоту в крові. Так, при вмісті білка в їжі 0,5 г/кг рівень сечовини дорівнює 3,2 ммоль/л, при 1,5 г/ кг — 6,4 ммоль/л, при 2,5 г/кг — 7,6 ммоль/л. Деякою мірою показником, Ш° відображає стан білкового обміну в організмі, служить екскреція кінцевй* продуктів обміну білка з сечею. Один з важливих кінцевих продуктів обміну білка — аміак, є токсичною речовиною. Він підлягає знешкодженню: а) шляхом виділення солей амонію через нирки; б)перетворенням в нетоксичну сечовину;
в) зв’язуванням з а-кетоглутаровою кислотою в глутамат; г) зв’язуванням з глутаматом під дією ферменту глутамінсинтетази в глутамін.
У дорослої людини продукти азотистого обміну виводяться з сечею головним чином у вигляді малотоксичної сечовини, рівень якої у дорослих становить 60-80% загальної кількості азоту, що виводиться. У новонароджених і дітей перших місяців життя процент сечовини нижчий (20-30% загальної кількості азоту в сечі). У дітей віком до 3 міс. виділяється 0,14 г/кг сечовини за добу, 9-12 міс. — 0,25 г/кг.
У новонародженого значну кількість в загальному азоті сечі становить сечова кислота. Діти до 3 міс. виділяють 28,3 мг/кг, дорослі — 8,7 мг/кг цієї кислоти. Надмірний її вміст в сечі є причиною сечокислого інфаркту нирок, який спостерігається у 75% новонароджених. Крім того, організм дитини раннього віку виводить азот білка у вигляді аміаку, вміст якого становить 10- 15%, у дорослого — 2,5-4,5% загального азоту. Це пояснюється тим, що у дітей перших трьох місяців життя функція печінки розвинена недостатньо, тому надмірне білкове навантаження може призвести до появи токсичних продуктів обміну та їх накопичення в крові.
Креатинін виділяється з сечею. Його виділення залежить від розвитку м’язової системи. У недоношених за добу виділяється 3 мг/кг креатиніну, у доношених новонароджених — 10-13 мг/кг, у дорослих — 1,5 г/кг.
Як відомо, у дорослих в сечі креатин в нормі відсутній (може бути лише при міопатії). У новонароджених дітей має місце фізіологічна креатинурія. У школярів різного віку також може з’являтися креатин в сечі і при втомі його кількість збільшується.
Регуляція обміну білка здійснюється нейрогуморальним шляхом. Деякі гормони гіпофіза (соматотропний), статевих залоз (андрогени, тестостерон), Щитовидної залози (тироксин і трийодтиронін у фізіологічних дозах) посилюють синтез білків в організмі. Побічний вплив має інсулін. Глюко- кортикоїдні гормони надниркової залози, навпаки, посилюють розпад білка. Значно впливають на метаболізм білка вітаміни, особливо вітамін В6 (піридоксин), який бере участь приблизно у 20 реакціях обміну амінокислот.
Діти більш чутливі до голодування, ніж дорослі. У країнах, де спостерігається різкий дефіцит білка в харчуванні дітей, смертність зростає в ранньому В|ЦІ в 20-50 разів. Оскільки білок необхідний також для синтезу антитіл, як правило, при його дефіциті в харчуванні у дітей часто виникають різні інфекції, які в свою чергу підвищують потребу в білку. Створюється порочне коло. Останнім часом встановлено, що недостатність білка в раціоні харчування дітей Перших трьох років життя, особливо тривала, може викликати незворотні зміни, які зберігаються довічно. Є дані, що інтелектуальний індекс школярів, у яких в ранньому віці (до 3 років) була білкова недостатність, нижчий, ніж у їх одноліток. Навіть дорослі, які голодували в ранньому віці, гірше переносять стресові ситуації, у них більш уповільнена реакція тоді, коли необхідно швидко прийняти рішення і виконати їх.
У дітей дефіцит білка в харчуванні проявляється зміною поведінки. Спочатку дитина стає роздратованою, неспокійною. Потім (якщо голодування продовжується) неспокій змінюється млявістю, апатією і сонливістю. Зменшується жирова підшкірна клітковина. Уповільнюється, а потім припиняється збільшення маси тіла, а дещо пізніше (через 3-6 міс.) і росту. У дітей раннього віку відносно рано проявляється набряковий синдром. Особливо характерний набряк стоп. Виникає депігментація волосся, розхитаність його коренів, волосся стає тонким, рідким, прямим, обличчя — місяцеподібним. З’являється гепатомегалія, і розвивається дерматоз. У дітей старшого віку тривала білково-калорійна недостатність проявляється м’язовим виснаженням, збільшенням привушних залоз (у школярів), гінекомастією. При дослідженні крові виявляється зниження рівня альбумінів і навіть загального білка.
Поряд з кількісним дефіцитом білка у дітей перших років життя при неправильному харчуванні може розвинутися і якісна білкова недостатність внаслідок дефіциту життєво важливих амінокислот, що містяться в молоці. Цей стан відомий під назвою «квашіоркор». Термін запропонував Вільямс у 1933 р. (син. «червона дитина», «зміїна шкіра» та ін). Квашіоркор звично виникає після припинення годування груддю, коли в раціоні харчування майже не використовується молоко і молочні продукти, що містять оптимальний набір амінокислот. Його постійними симптомами поряд зі зміною поведінки дитини (спочатку роздратованість і неспокій, що змінюються млявістю і апатією, відставання в психічному розвитку) є набряки внаслідок гіпопротеїнемії, затримка фізичного розвитку (спочатку втрата маси тіла), м’язова виснаженість. Розвиваються шарувато-пігментований дерматоз, гепатомегалія. В результаті зниження імунітету легко приєднується туберкульоз, інфекції, які набувають генералізованого характеру (сепсис, менінгіт). Білкова недостатність завжди супроводжується гіповітамінозом, тому у таких хворих виявляються різні прояви полігіповітамінозу.
Перетравлення білків їжі відбувається в шлунку і кишках. Під впливом ферментів (пепсин, трипсин, полі- і дипептидази) білки розщеплюються до амінокислот, які активуються і резорбуються через слизову оболонку кишок. У разі зниження протеолітичної активності шлунка і підшлункової залози спостерігається порушення дистантного перетравлення білків, які У малозміненому вигляді переходять до тонкої кишки. Це зустрічається прй захворюваннях шлунка (атрофічний гастрит з ахілією) або панкреатитах. У дітей першого року життя внаслідок відносно невисокої протеолітичної активності спостерігається подібна картина при надмірному вживанні білків, особливо коров’ячого молока і його продуктів. Оскільки білок може частково утилізуватися в процесі піноцитозу, він потрапляє до кровообігу в малозміненому вигляді і є однією з причин харчової алергії, що підтверджується виявленням антитіл до білка коров’ячого молока, циркулюючих у крові.
До захворювань, в основі яких лежать порушення розщеплення і всмоктування, незвичайна ідіосинкразія до деяких білків рослинного походження (гліадін), належить целіакія, що виникає у випадках, коли дитина починає споживати продукти, які містять гліадін і глютен. Клінічно целіакія проявляється поліфекалією (більше 2% від вжитої їжі). Кал звичайно рідкий, частіше пінистого характеру і у вигляді опари. В результаті поносу розвивається гіпотрофія, незвичайна зовнішність — вигляд «павука», коли у сильно виснаженої дитини живіт більший внаслідок псевдоасциту, а кінцівки тонкі. При дослідженні біоптату слизової оболонки кишок виявляється атрофічний єюніт. З раціону харчування слід виключити продукти, що містять гліадін (глютен). Через деякий час після цього зникає і атрофія слизової оболонки. Подібний стан, на відміну від вродженої форми, може виникнути і після деяких кишкових інфекцій, нераціонального застосування антибіотиків тощо. У цих випадках мова йде про синдром целіакії, який краще піддається корекції відповідною дієтотерапією.
Схожий на целіакію стан може спостерігатися і при невиносності білка коров’ячого молока, однак він виникає вже в першому півріччі життя. При дослідженні біоптату слизової оболонки тонкої кишки виявляється її субатрофія. У цих випадках потрібно виключити з раціону коров’яче молоко і його продукти.
Встановлено, що резорбція амінокислот слизовою оболонкою тонкої кишки можлива лише при їх активації, яка полягає в приєднанні до амінокислот залишку фосфорної кислоти. При генетично обумовленому або набутому порушенні активації амінокислот спостерігається схожий на целіакію синдром мальабсорбції.
Амінокислоти, що всмоктуються з кишок у кров, за системою V.portae надходять до печінки, в якій вони або утилізуються або розщеплюються, або розносяться по всьому організму. Процес обміну амінокислот відбувається у вигляді окисного дезамінування, переамінування і декарбоксилювання. В основі всіх обмінних реакцій лежать ферменти. Так, процес переамінування здійснюється трансаміназами, а декарбоксилювання — декарбоксилазами амінокислот. Ці процеси відбуваються, як правило, внутрішньоклітинно. Побічно про інтенсивність процесу обміну амінокислот можна міркувати на основі як кількості утворених кінцевих продуктів їх обміну, так і активності Ферменту.
При народженні активність трансаміназ крові дитини у 2 рази вища, ніж в КР°ві її матері. На 8-й день життя активність трансаміназ зростає ще більше, а Починаючи з кінця 2 року життя поступово знижується. Таким чином, процес переамінування у дітей відбувається більш інтенсивно. В той же час метаболізм окремих амінокислот формується поступово, чим і можна пояснити наявність у дітей перших трьох місяців життя аміноацидемії.
Різні порушення білкового обміну супроводжуються досить вираженою клінічною симптоматикою. Так, у дітей з хворобою «кленового листа», в основі якої лежить порушення метаболізму гіллястих амінокислот (валін, лейцин та ізолейцин), відчувається запах паленого цукру або карамелі, що пояснюється присутністю а-кетонової кислоти або гідрооксіациду — сполуки ізолейцину (запах з’являється після 5-го дня життя). Запах риби, згірклого масла описаний при гіперметіонінемії, присутності а-гідроокису бутирової кислоти. При порушенні метаболізму лейцину (лейциноз) з’являється запах пітливих ніг внаслідок затримки і накопичення ізовалеріанової кислоти. У випадках гліценозу від новонародженого відчувається запах ацетону (яблучний запах). Інтенсивність запаху при аміноацидопатіях може сильно коливатися; особливо сильно він відчутний від свіжої сечі, але в той же час запах може бути відсутній.
Другим і навіть частішим проявом різних аміноацидопатій є нервово- психічні порушення. Відставання у нервово-психічному розвитку у вигляді різного ступеня олігофренії властиве багатьом аміноацидопатіям (феніл-кетонурії, гомоцистинурії, гістидінемії, гіперптонемії, цитрулінемії, гіперпролійемії, хворобі Хартнупа та ін.), що підтверджується їх значним поширенням, яке перевищує в десятки і сотні разів поширення в загальній популяції. Судомний синдром нерідко виявляється у дітей, хворих на аміноацидопатії, причому судоми вперше можуть з’явитися в перші тижні життя. Часто спостерігаються флексорні спазми. Особливо вони властиві фенілкетонурії, а також зустрічаються при порушенні обміну триптофану і вітаміну В6 (піридоксину), при гліцинозі, лейцинозі, пролінурії тощо.
Нерідко спостерігаються зміни м’язового тонусу у вигляді гіпотонії (гіперлізинемія, цистдаурія, гліциноз та ін.) або, навпаки, гіпертонії (лейциноз, гіперурикемія, хвороба Хартнупа, гомоцистинурія та ін.). Зміна м’язового тонусу може періодично посилюватися або слабшати. Затримка розвитку мови властива при гістидінемії. Розлади зору часто зустрічаються при аміноацидопатіях ароматичних і сірковмістних амінокислот (альбінізм, феніл- кетонурія, гістидінемія), відкладання пігменту — при алкаптонурії, вивих кришталика — при гомоцистинурії.
Зміни шкіри при аміноацидопатіях спостерігаються часто. Порушення (первинні та вторинні) пігментації властиві альбінізму, фенілкетонурії, рід11іе гістидінемії і гомоцистинурії. Непереносимість сонця (сонячні опіки) прй відсутності загару спостерігається при фенілкетонурії. Навпаки, пелагроїдня шкіра властива хворобі Хартнупа, екзема — фенілкетонурії. При аргінін- сукцинатній аміноацидурії спостерігається ламкість волосся.
Шлунково-кишкові симптоми досить часто відмічаються при амінО´ ацидеміях. Труднощі в харчуванні, нерідко блювота майже з дня народженні властиві гліцинозу, фенілкетонурії, тирозинозу, цитрулінемії та ін. Блювота може бути приступоподібна і викликати швидку дегідратацію і сопорозний стан, іноді кому з судомами. При високому вмісті білка спостерігається підсилення і прискорення блювоти. При гліцинозі вона супроводжується кетонемією і кетонурією, порушенням дихання.
Нерідко при аргінін-сукцинатній аміноацидурії, гомоцистинурії, гіперметіонінемії, тирозинозі спостерігається ураження печінки аж до розвитку цирозу з портальною гіпертензією і шлунково-кишковою кровотечею.
При гіперпролінемії відмічається ниркова симптоматика (гематурія, протеїнурія). Можуть спостерігатися зміни в крові. Анемія властива гіперлізинемії, лейкопенія і тромбоцитопатія – гліцинозу. При гомоцистинурії може підвищуватися агрегація тромбоцитів з розвитком тромбоемболії.
Серед різноманітних вроджених захворювань, в основі яких лежить порушення метаболізму білків, часто зустрічаються аміноацидемії, основною яких є дефіцит ферментів, що беруть участь у їх обміні. В даний час описано більше 20 різних видів аміноацидопатій. Розглянемо деякі найбільш вивчені і поширені спадково обумовлені порушення обміну ряду амінокислот, передусім фенілаланіну та тирозину.
Так, при фенілкетонурії поява дефектної фенілаланінгідроксилази призводить до того, що з фенілаланіну не утворюється тирозин (рис. 47,А). Тоді взамін активується такий другорядний шлях метаболізму фенілаланіну, як його трансамінування. Це викликає накопичення в крові та тканинах фенілпірувату та фенілаланіну. При цьому особливо пошкоджується тканина мозку. У випадку фенілкетонурії має місце значне порушення обміну біогенних амінів.
Клінічні її прояви досить різноманітні. Захворювання проявляється тим, Що дитина відстає в розумовому розвитку. Воно супроводжується особливим запахом у дітей перших тижнів життя. Від дитини йде специфічний запах миші (або плісняви, сечі коня, хижого звіра). Утворений внаслідок цього порушення побічний продукт — ацетофенілова кислота — є причиною появи вказаного запаху. Захворювання може проявитися у ранньому віці.
При алкаптонурії спостерігається дефіцит ферменту 1,2-діоксигеназа гомо- ґентизинової кислоти, що каталізує подальше перетворення останньої (рис. 18, В)- В таких випадках з сечею виділяється багато гомогентизинової кислоти, яка темніє на повітрі (окислюється), і сеча набуває темного кольору. Захворювання спочатку перебігає безсимптомно. З віком гомогентизинова кислота відкладається в різноманітних органах, полімерізуючись при цьому. Суглоби Набрякають, обмежується їх рухливість. Кістки стають ламкими. Порушується Діяльність серцево-судинної системи. Розвивається симптомокомплекс хронозу (блідо-жовтий), уповільнюються процеси дифузії в сполучній тканині.
При алкаптонурії іноді спостерігається ціаноз, оскільки хілоїдна форма гомогентизинової кислоти перетворює гемоглобін в метгемоглобін.
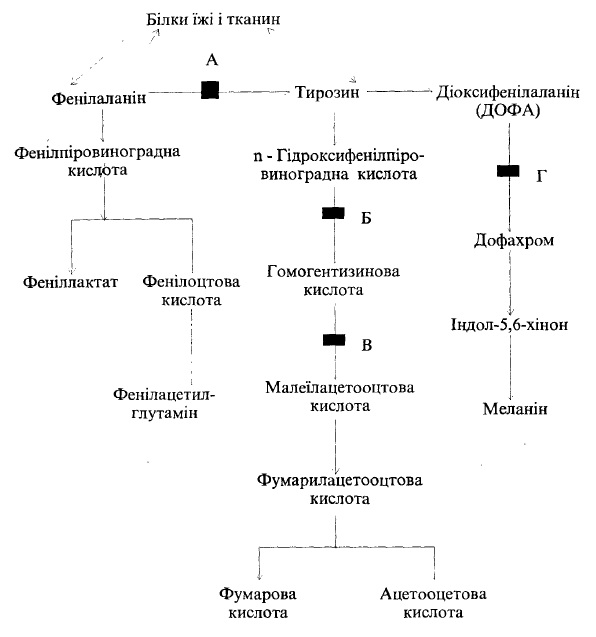
Рис. 47. Схема основних метаболічних шляхів фенілаланіну і тирозину.
Літерами позначений блок хімічної реакції при деяких захворюваннях: А – фенілкетонурії; Б — при тирозинозі; В – при алкаптонурії; Г — при альбінізмі
Тирозиноз-гідроксифенілурія є результатом пригнічення активності ферменту n-гідроксифенілпіруватгідроксилази, що окислює в присутності вітаміну С n-гідроксифенілпіруват в гомогентизинову кислоту (рис. 47, Б). Метаболічна блокада на цьому рівні призводить до накопичення та виділення з сечею n-гідроксифенілпірувату, тирозину, п-гідроксифенілмолочної та парагідроксифенілоцтової кислот. Ця патологія зустрічається досить рідко, але часто супроводжується різними аномаліями: передчасними пологами, дефіцитом вітаміну С (особливо при дієті, збагаченій білками), дефіцитом фолієвої кислоти, ревматизмом та анеміями, печінковою недостатністю.
В організмі дитини в меланоцитах може бути відсутній фермент тирозиназа, що каталізує перетворення діоксифенілаланіну в дофахром, який необхідний для утворення меланіну (рис. 47, Г). В результаті такого дефіциту ферменту виникає альбінізм, який характеризується відсутністю пігменту в шкірі, волоссі та сітківці.
Фермент може бути присутній в мітохондріях меланоцитів в неактивному стані. Його активаторами є слідова кількість 3,4-діоксифенілаланіну та ультрафіолетові промені. Якщо фермент в меланоцитах неактивний, то спостерігаються сонячні опіки та ураження органа зору, оскільки немає захисту від світлових променів.
Поряд з розладами обміну амінокислот можуть спостерігатися захворювання, в основі яких лежить порушення синтезу білків, що відіграють важливу роль в організмі (наприклад, антигемофільних глобулінів — при гемофілії, хворобі Віллебранда, фібриногену — при афібриногенемії, що характеризуються підвищеною кровоточивістю), або аномальних білків (глобіну — при гемоглобінозах, макроглобулінемії та ін.).
Таким чином, порушення обміну білка можуть спостерігатися як на рівні його гідролізу і всмоктування в травному каналі, так і інтермедіарного метаболізму. Важливо підкреслити, що розлади метаболізму білка, як правило, супроводжуються порушенням й інших видів обміну, оскільки до складу майже всіх ферментів входить білкова частина.